题目内容
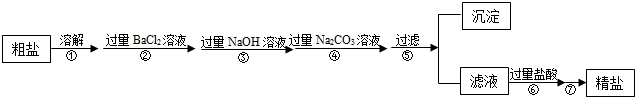
现有一包固体粉末,可能由CaCO3、CaO、Na2CO3中的一种或几种组成,为确定其组成,进行了如图所示的实验(假设实验过程无损耗).

请回答:
(1)根据实验可以确定白色沉淀是 ;X溶液中一定含有的溶质是 .
(2)原固体粉末中一定含有 ,它的可能组成有 种.

请回答:
(1)根据实验可以确定白色沉淀是
(2)原固体粉末中一定含有
考点:物质的鉴别、推断,生石灰的性质与用途,盐的化学性质
专题:常见物质的推断题
分析:根据碳酸钙是难溶于水的白色沉淀,氧化钙和水会生成氢氧化钙,氢氧化钙和碳酸钠会生成白色的碳酸钙沉淀,碳酸钙、碳酸钠与盐酸反应会生成二氧化碳气体等知识进行分析.
解答:解:碳酸钙是难溶于水的白色沉淀,氧化钙和水会生成氢氧化钙,氢氧化钙和碳酸钠会生成白色的碳酸钙沉淀,碳酸钙、碳酸钠与盐酸反应会生成二氧化碳气体.
(1)将白色粉末加入足量水后产生白色沉淀,可知该白色沉淀应该为碳酸钙,化学式为:CaCO3,得到的无色溶液能够和稀盐酸反应生成气体,可以知道在固体粉末中一定含有碳酸钠,从而可以判断在X溶液中一定含有氯化钠,化学式为:NaCl;
(2)依据(1)的分析可以知道,在混合物中一定含有碳酸钠,而白色沉淀碳酸钙可能是混合物中原来就有的,结合氧化钙可以和水反应生成氢氧化钙这一知识点,可以判断白色沉淀也可能是碳酸钠与氢氧化钙发生了反应而生成的,所以碳酸钙和氧化钙都为可能含有的物质,所以它可能的组合为:①碳酸钠,氧化钙;②碳酸钠,碳酸钙;③碳酸钠,氧化钙,碳酸钙等三种可能的组成,所以原固体粉末中一定含有:Na2CO3,它的可能组成有3种.
故答案为:(1)CaCO3,NaCl;
(2)Na2CO3,3.
(1)将白色粉末加入足量水后产生白色沉淀,可知该白色沉淀应该为碳酸钙,化学式为:CaCO3,得到的无色溶液能够和稀盐酸反应生成气体,可以知道在固体粉末中一定含有碳酸钠,从而可以判断在X溶液中一定含有氯化钠,化学式为:NaCl;
(2)依据(1)的分析可以知道,在混合物中一定含有碳酸钠,而白色沉淀碳酸钙可能是混合物中原来就有的,结合氧化钙可以和水反应生成氢氧化钙这一知识点,可以判断白色沉淀也可能是碳酸钠与氢氧化钙发生了反应而生成的,所以碳酸钙和氧化钙都为可能含有的物质,所以它可能的组合为:①碳酸钠,氧化钙;②碳酸钠,碳酸钙;③碳酸钠,氧化钙,碳酸钙等三种可能的组成,所以原固体粉末中一定含有:Na2CO3,它的可能组成有3种.
故答案为:(1)CaCO3,NaCl;
(2)Na2CO3,3.
点评:本题为框图式物质推断题,完成此类题目,关键是找准解题突破口,根据物质的化学特性直接得出结论,然后利用顺推或逆推或从两边向中间推断,逐步得出其他结论.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、原子核内部都含有质子和电子 |
| B、分子体积一定比原子体积大 |
| C、物质都是由分子构成的 |
| D、原子的质量主要集中在原子核上 |