题目内容
6.工业上用纯碱和石灰石为原料制备烧碱的简要工艺流程如图1所示,请回答下列问题.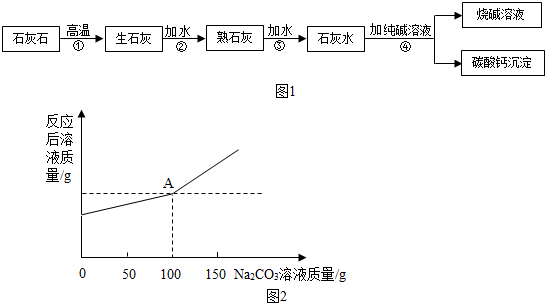
(1)石灰石、生石灰、熟石灰均能与下列B(填字母)发生化学反应.
A.水 B.盐酸 C.二氧化碳
(2)步骤②发生反应的化学方程式是CaO+H2O=Ca(OH)2.
(3)某研究性学习小组的同学,想检验上述工艺中的烧碱溶液里是否含有纯碱,甲同学选择
了一种酸溶液,乙同学选择了一种碱溶液,丙同学也选择了一种溶液,该溶液中溶质与
甲、乙同学所用溶液中溶质的物质类别不同,他们都能达到检验目的.你认为丙同学所
选溶液中的溶质可能是CaCl2(填一种物质的化学式).
(4)在室温下,向盛有一定质量澄清石灰水的烧杯中逐滴加入溶质质量分数为5.3%的Na2CO3溶液,烧杯中溶液质量变化与滴入Na2CO3溶液的质量关系如图2所示.计算恰好完全反应时,所得不饱和溶液中溶质的质量(计算结果精确至0.1g)
分析 (1)根据石灰石、氧化钙不会与二氧化碳反应,石灰石不会与水反应,碳酸钙、氧化钙、氢氧化钙都会与盐酸反应进行分析;
(2)根据步骤②发生的反应氧化钙和水反应生成氢氧化钙进行分析;
(3)根据甲同学选择了一种酸溶液,乙同学选择了一种碱溶液,丙同学也选择了一种溶液,该溶液中溶质与甲、乙同学所用溶液中溶质的物质类别不同,所以丙同学选择的是盐溶液,可以是氯化钙进行分析;
(4)根据碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,体局题中的数据进行计算.
解答 解:(1)石灰石、氧化钙不会与二氧化碳反应,石灰石不会与水反应,碳酸钙、氧化钙、氢氧化钙都会与盐酸反应,故选:B;
(2)步骤②发生的反应氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(3)甲同学选择了一种酸溶液,乙同学选择了一种碱溶液,丙同学也选择了一种溶液,该溶液中溶质与甲、乙同学所用溶液中溶质的物质类别不同,所以丙同学选择的是盐溶液,可以是氯化钙,化学式为:CaCl2;
(4)100g质量分数为5.3%的Na2CO3溶液中含Na2CO3的质量为:100g×5.3%=5.3g,
设反应中生成NaOH的质量为x
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 80
5.3 g x
$\frac{106}{5.3g}$=$\frac{80}{x}$
x=4.0g
答:所得不饱和溶液中溶质NaOH的质量是4.0g.
故答案为:(1)B;
(2)CaO+H2O=Ca(OH)2;
(3)CaCl2(或 BaCl2等);
(4)所得不饱和溶液中溶质NaOH的质量是4.0g.
点评 本题的难度不大,掌握碳酸钙、氧化钙、氢氧化钙的性质、碳酸根离子的检验方法等是正确解答本题的关键.

| A. | 用汽油洗去手上的油污 | B. | 用洗洁精洗去餐具上的油污 | ||
| C. | 用酒精洗去试管中的碘 | D. | 用稀盐酸洗去铁制品表面的铁锈 |
①Cu ②Fe、Cu ③Zn、Fe ④Zn、Cu ⑤Zn、Fe、Cu.
| A. | ②⑤ | B. | ②③ | C. | ②③④⑤ | D. | ①②⑤ |

| A. | 燃料电池系统中有不同的能量转化 | |
| B. | 该能量转化系统中的水可以循环使用 | |
| C. | 氢气使用前要检验其纯度,防止爆炸 | |
| D. | 在水电解系统发生的化学反应中,氢元素的化合价从0价变化到了+1价 |
 自热米饭是一种快餐食品,请根据图1中信息回答下列问题:
自热米饭是一种快餐食品,请根据图1中信息回答下列问题:自热米饭的营养成分:
| 营养素 | 每份含量 |
| 蛋白质 | 29.6g |
| 油脂 | 23.5g |
| 糖类 | 104.7g |
| 钠 | 814mg |
(2)菜肴包的包装袋材料是铝箔,①铅箔属于金属材料,铝可以压制成铝箔,说明铝具有良好的延展性;
②如图2是铝箔在氧气中燃烧的实验,集气瓶底铺上一层细沙,其作用是防止溅落的熔化物炸裂瓶底.
③铝能与稀盐酸反应,相应的化学方程式是2Al+6HCl═2AlCl3+3H2↑,铝还能与氢氧化钠溶液反应,相应的化学方程式是:2Al+2NaOH+2H2O═2NaAlO2+3X↑.该反应中X的化学式为H2.
(3)该自热米饭是利用发热包中的生石灰与水反应放出热量来进行加热,生石灰与水反应的化学方程式为CaO+H2O═Ca(OH)2,其基本反应类型是化合反应.

 (1)图甲是水通电分解的示意图,在实验过程中,试管a中产生的气体是氧气(填名称).
(1)图甲是水通电分解的示意图,在实验过程中,试管a中产生的气体是氧气(填名称).