题目内容
8.下列实验方法错误的是( )| A. | 用灼烧的方法鉴别羊毛和涤纶 | |
| B. | 用紫色石蕊溶液鉴别CO2和CO气体 | |
| C. | 用酚酞鉴别稀盐酸和氯化钠溶液 | |
| D. | 用水鉴别硝酸铵固体和氢氧化钠固体 |
分析 A、根据蛋白质的特点回答;
B、根据二氧化碳和水反应生成碳酸,碳酸能使石蕊试液变红进行解答;
C、根据稀盐酸呈酸性,氯化钠溶液呈中性,都不能使酚酞试液变红进行解答;
D、根据物质溶于水的热量变化来做题.
解答 解:A、羊毛中含有蛋白质,在灼烧时有烧焦羽毛气味,故用灼烧的方法可以鉴别羊毛和涤纶,故A正确;
B、二氧化碳和水反应生成碳酸,碳酸能使石蕊试液变红,所以可用紫色石蕊溶液鉴别CO2和CO气体,故B正确;
C、稀盐酸呈酸性,氯化钠溶液呈中性,都不能使酚酞试液变红,所以不能用酚酞鉴别稀盐酸和氯化钠溶液,故C错误;
D、硝酸铵固体溶于水吸热,使溶液温度降低,氢氧化钠固体溶于水放热,温度升高,所以用水能鉴别硝酸铵和氢氧化钠固体,故D正确.
故选:C.
点评 本题难度不大,化学实验方案的设计是考查学生能力的主要类型,同时也是实验教与学难点,在具体设计时要对其原理透彻理解,可根据物质的物理性质和化学性质结合实验目的进行分析判断.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
13.物质的用途与性质密切相关,下列说法合理的是( )
| A. | 无水硫酸铜用于检验水份的存在 | |
| B. | 碱石灰用于干燥CO2气体 | |
| C. | Ca(OH)2可用于治疗缺钙症 | |
| D. | NaOH溶液能吸收污染空气的有害气体NO2、SO2和CO |
20.下图是一组垃圾箱及说明:
(1)小明在整理房间时,清理出如下物品,A.废作业本;B.可乐易拉罐;C.生锈铁钉;D.矿泉水瓶;E.烂苹果;F.涂改液瓶;G.废布料,它们应分别放入哪个垃圾箱(填序号):
应放入“可回收垃圾箱”的是:ABCDG.应放入“不可回收垃圾箱”的是:E.应放入“有害垃圾箱”的是:F.
(2)小明用盐酸除去铁钉上的锈(主要成分为氧化铁),以便重新使用它,请写出除铁锈的化学方程式Fe2O3+6HCl=2FeCl3+3H2O.
(3)世界卫生组织把铝确定为食品污染源之一并加以控制使用,在①制铝合金;②制电线;③制餐饮具;④制银色漆的原料;⑤制装饮料的易拉罐;⑥包装糖果和小食品中,应加以控制使用的是③⑤⑥(填序号)
(4)解决“白色污染”问题,下列做法不宜提倡的是D
A.使用新型可降解塑料 B.用布袋代替塑料袋 C.回收废弃塑料 D.焚烧废弃塑料
(5)检验一块废布料中是否含有羊毛成分的方法是将其燃烧,闻是否有烧焦羽毛的气味.
(6)环境问题的重要性也成为各国政府的注意点,各国纷纷打出“环境”牌,并且放在第一位.保持空气清洁,保护人类健康.这里空气在化学物质分类中,属于混合物.
| 生活垃圾分类 | ||
| 可回收垃圾 | 不可回收垃圾 | 有害垃圾 |
| 1、纸类 2、玻璃 3、金属 4、塑料 5、橡胶 6、纺织品 | 1、厨房垃圾 2、灰土 3、杂草 4、枯枝 5、花卉 | 1、日光灯 2、电池 3、喷雾罐 4、指甲油瓶 5、药品瓶 6、涂改液瓶 |
应放入“可回收垃圾箱”的是:ABCDG.应放入“不可回收垃圾箱”的是:E.应放入“有害垃圾箱”的是:F.
(2)小明用盐酸除去铁钉上的锈(主要成分为氧化铁),以便重新使用它,请写出除铁锈的化学方程式Fe2O3+6HCl=2FeCl3+3H2O.
(3)世界卫生组织把铝确定为食品污染源之一并加以控制使用,在①制铝合金;②制电线;③制餐饮具;④制银色漆的原料;⑤制装饮料的易拉罐;⑥包装糖果和小食品中,应加以控制使用的是③⑤⑥(填序号)
(4)解决“白色污染”问题,下列做法不宜提倡的是D
A.使用新型可降解塑料 B.用布袋代替塑料袋 C.回收废弃塑料 D.焚烧废弃塑料
(5)检验一块废布料中是否含有羊毛成分的方法是将其燃烧,闻是否有烧焦羽毛的气味.
(6)环境问题的重要性也成为各国政府的注意点,各国纷纷打出“环境”牌,并且放在第一位.保持空气清洁,保护人类健康.这里空气在化学物质分类中,属于混合物.
17.某化学兴趣小组进行了复分解反应发生条件的探究实验.
(1)氢氧化钠和硫酸铜溶液能发生反应,是因为有沉淀生成,符合复分解反应发生条件
(2)对盐酸和氢氧化钠反应后溶液中的溶质进行探究.
【做出猜测】
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
猜想四:有HClNaOH
你认为猜想猜想四不合理,其理由是HCl和NaOH不能共存
【设计实验】
(3)粗盐水中除含NaCl外,还含有MgCl2、CaCl2、Na2SO4等杂质,以下是将粗盐水进行提纯得到氯化钠的实验流程:
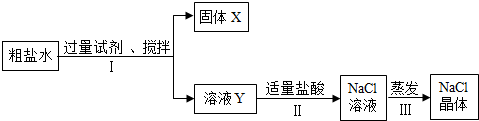
回答下列问题:
①固体X中含有的物质有硫酸钡、氢氧化镁和碳酸钙
②步骤I所加试剂中,不能用Ba(NO3)2代替BaCl2,其原因是什么?
(4)用氢氧化钠溶液中和一定量石油产品中的残余硫酸至中性,共消耗5%的氢氧化钠溶液80%,则此石油产品中含H2SO4的质量是多少?
(1)氢氧化钠和硫酸铜溶液能发生反应,是因为有沉淀生成,符合复分解反应发生条件
(2)对盐酸和氢氧化钠反应后溶液中的溶质进行探究.
【做出猜测】
猜想一:只有NaCl
猜想二:有NaCl和NaOH
猜想三:有NaCl和HCl
猜想四:有HClNaOH
你认为猜想猜想四不合理,其理由是HCl和NaOH不能共存
【设计实验】
| 实验操作 | 实验现象 | 实验结论 |
| 取反应后的溶液于试管中,加入 少量的碳酸钠 | 有气泡生成 | 猜想三成立 |

回答下列问题:
①固体X中含有的物质有硫酸钡、氢氧化镁和碳酸钙
②步骤I所加试剂中,不能用Ba(NO3)2代替BaCl2,其原因是什么?
(4)用氢氧化钠溶液中和一定量石油产品中的残余硫酸至中性,共消耗5%的氢氧化钠溶液80%,则此石油产品中含H2SO4的质量是多少?
18.归纳和比较是学习化学的重要方法.对待同一个问题,从不同的角度我们可以找到不同的规律,从而得出不同的答案.请完成下表(每种物质只能选用一次):
| 物 质 | 与众不同的物质 | 理 由 |
| KCl、K2SO4、 KOH、BaSO4 | 如:BaSO4 | 难溶于水,其它三种物质都易溶于水 |
| KOH | 属于碱,其它三种都属于盐(或含H元素,其它三种都不含H) | |
| KCl | 含氯元素不含氧元素,其它三种含氧元素而不含氯元素 |
 回答下列问题;
回答下列问题;

 已知甲、乙、丙、丁是初中化学常见的物质,它们之间转化关系如图:若甲、丁是常见的碱,乙、丙是常见的盐,而且当甲转化为丙、丁转化为乙时,都是与同一种气体X发生反应.则X的化学式为CO2,甲与乙反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH:丁转化为乙的化学方程式为2NaOH+CO2=Na2CO3+H2O.
已知甲、乙、丙、丁是初中化学常见的物质,它们之间转化关系如图:若甲、丁是常见的碱,乙、丙是常见的盐,而且当甲转化为丙、丁转化为乙时,都是与同一种气体X发生反应.则X的化学式为CO2,甲与乙反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH:丁转化为乙的化学方程式为2NaOH+CO2=Na2CO3+H2O.