题目内容
8g氢氧化钠与一定量的盐酸恰好完全反应,形成氯化钠的饱和溶液.已知在该温度下氯化钠的溶解度是36g,求该盐酸中溶质的质分数.
答案:
解析:
解析:
|
解:设盐酸的质量为x,质量分数为y%,反应后生成氯化钠的质量为z. NaOH+HCl= NaCl+H2O 40 36.5 58.5 8g y%·x z 40∶8g=36.5∶y%·x ∴x·y%=7.3g 40∶8g=58.5∶z ∴z=11.7g ∵反应后的溶液中有NaCl 11.7g,水为8g+x-11.7g. 100g∶36g=(8g+x-11.7g)∶11.7g ∴x=36.2g 将x=36.2g代入x·y%=7.3g ∴y%=20.2% |

练习册系列答案
相关题目
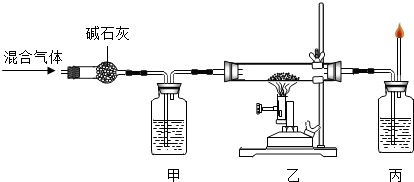
 H2、CO、和CH4都是初中化学常见的气体.
H2、CO、和CH4都是初中化学常见的气体.