题目内容
3.有四瓶失去标签的溶液:硝酸钡、碳酸钠、稀硫酸、盐酸.为了鉴别它们做了如下实验,根据现象推断A、B、C、D分别是什么物质,写出它们的化学式和有关的化学方程式.A和B混合有无色气体放出 D和B混合有无色气体放出 C和A混合没有明显现象.
则A是稀盐酸B是碳酸钠C是硝酸钡D是稀硫酸.
A+B的反应方程式Na2CO3+2HCl═2NaCl+H2O+CO2↑
D+B的反应方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
C+D的反应方程式Ba(NO3)2+H2SO4═BaSO4↓+2HNO3.
分析 有四瓶失去标签的溶液:硝酸钡、碳酸钠、稀硫酸、盐酸,A和B混合有无色气体放出 D和B混合有无色气体放出 C和A混合没有明显现象,结合碳酸钠与稀盐酸、稀硫酸反应均生成二氧化碳气体,则B为碳酸钠溶液,C为硝酸钡溶液;C和A混合没有明显现象,由硝酸钡与稀硫酸反应生成硫酸钡白色沉淀,与稀盐酸不反应,则A为稀盐酸,D为稀硫酸;据此进行分析解答.
解答 解:有四瓶失去标签的溶液:硝酸钡、碳酸钠、稀硫酸、盐酸,A和B混合有无色气体放出 D和B混合有无色气体放出 C和A混合没有明显现象,碳酸钠与稀盐酸、稀硫酸反应均生成二氧化碳气体,则B为碳酸钠溶液,C为硝酸钡溶液;C和A混合没有明显现象,由硝酸钡与稀硫酸反应生成硫酸钡白色沉淀,与稀盐酸不反应,则A为稀盐酸,D为稀硫酸.
A+B反应,即碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
D+B反应,稀硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳,反应的化学方程式为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
C+D反应,硝酸钡与稀硫酸反应生成硫酸钡沉淀和硝酸,反应的化学方程式为:Ba(NO3)2+H2SO4═BaSO4↓+2HNO3.
故答案为:稀盐酸;碳酸钠;硝酸钡;稀硫酸.Na2CO3+2HCl═2NaCl+H2O+CO2↑;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;Ba(NO3)2+H2SO4═BaSO4↓+2HNO3.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.

练习册系列答案
相关题目
13.我们的生活离不开水,下列说法不正确的是( )
| A. | 自然界中的水都是混合物 | |
| B. | 硬水和软水可以使用肥皂水进行鉴别 | |
| C. | 电解水时,正极产生的气体具有可燃性 | |
| D. | 使用无磷洗衣费有利于保护水资源 |
14.某同学在参考书上看到方程式:Zn+2H2SO4(浓)═ZnSO4+SO2↑+2H2O,感到困惑,便进行了实验:向10g 98%的浓硫酸中加入锌粉,产生刺激性气味的气体,然后继续加入锌粉又有无味气体产生直到不再冒气泡.下列说法正确的是( )
| A. | 实验说明:同种物质的溶液浓度大小不同时,化学性质可能不同 | |
| B. | 实验中除了生成SO2,还会生成CO2 | |
| C. | 实验中生成SO2的质量等于3.2g | |
| D. | 用此反应制取ZnSO4与用锌与稀硫酸相比,不仅有污染,而且不经济 |
11.如图是A、B两物质的溶解度曲线图,下列说法正确的是( )
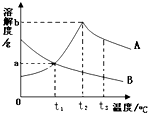

| A. | A物质的溶解度随温度升高而增大 | |
| B. | 将t1℃时A、B两物质的饱和溶液升温到t2℃,仍然都是饱和溶液 | |
| C. | 将t2℃时A、B两物质的饱和溶液升温到t3℃,仍然都是饱和溶液 | |
| D. | t1℃时,A、B两物质的饱和溶液溶质的质量分数都是a% |
18.天平两端的烧杯中各盛有100g9.8%的硫酸溶液,天平平衡.再向两个烧杯中同时分别加入下列某组金属,反应完全后,天平仍保持平衡,则符合此条件的金属组别是( )
| A. | 铁、锌各4g | B. | 铁、锌各5g | C. | 铁、锌各6g | D. | 铁、锌各7g |
8.结合如图回答有关在实验室里制取气体的问题.
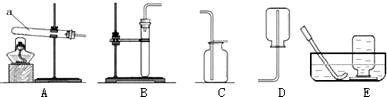
(1)仪器a的名称是试管;
(2)对实验室里制取气体进行归纳总结,填补表中空白:
(3)在实验室里用氯化铵和消石灰的混合物制取氨气时,选择的发生装置是A,由此推测,药品的状态为固体.

(1)仪器a的名称是试管;
(2)对实验室里制取气体进行归纳总结,填补表中空白:
| 制取气体 | 反应的化学方程式 | 反应物状态 | 反应条件 | 发生装置 | 气体的物理性质 | 收集装置 |
| O2 | ①2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | 固体 | 加热 | A | 不易溶于水密度比空气略大 | ②E(或C) |
| CO2 | CaCO3+2HCl═CaCl2+H2O+CO2↑ | 固体液体 | 常温 | ③B | 可溶于水密度比空气大 | C |
15.下列说法中正确的是( )
| A. | 爆炸一定是化学变化 | B. | 氧气和液氧的化学性质相同 | ||
| C. | 催化剂只能加快反应速率 | D. | 凡是发光、发热的现象都叫燃烧 |
13.根据如图的溶解度曲线,判断下列说法正确的是( )


| A. | t2℃时,甲物质的溶解度为60 | |
| B. | 乙物质的溶解度随温度的升高而增大 | |
| C. | 降低温度可使接近饱和的甲溶液变成饱和溶液 | |
| D. | tl℃时,甲、乙两物质的饱和溶液中含溶质的质量相等 |