题目内容
【题目】以下是一些制取气体的实验,某探究小组在实验室用下图所示装置制取气体
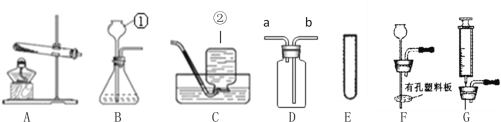
Ⅰ.写出仪器的名称:①_____________ ②_____________;
Ⅱ.实验室如果用KMnO4制取氧气所选择的发生装置为__________。实验室还可用粉末状碳酸钙与稀盐酸制取二氧化碳,由于反应太快,若要较好地控制产生二氧化碳的速度,可以从E~G中选取 _______(选填序号)组装成新的气体发生装置,写出该反应的化学方程式______________.
Ⅲ. 若用D装置进行排空气法收集二氧化碳,气体应从______(填“a”或“b”)端通入,检验二氧化碳已集满的方法是____________.
【答案】长颈漏斗 集气瓶 A E G CaCO3+2HCl=CaCl2+H2O+CO2↑ b 燃着的木条放在a端,是否熄灭。
【解析】
Ⅰ.仪器的名称:①长颈漏斗 ②集气瓶;
Ⅱ.高锰酸钾在加热条件下生成锰酸钾、二氧化锰、氧气,实验室如果用KMnO4制取氧气所选择的发生装置固固加热型A。实验室还可用粉末状碳酸钙与稀盐酸制取二氧化碳,由于反应太快,若要较好地控制产生二氧化碳的速度,可以从E~G中选取EG组装成新的气体发生装置,通过注射器可控制液体的滴加速率,而控制反应速率;F装置可控制反应的发生和停止,但不能控制反应速率,碳酸钙和盐酸反应生成氯化钙、二氧化碳、和水,该反应的化学方程式CaCO3+2HCl===CaCl2+H2O+CO2↑;
Ⅲ. 若用D装置进行排空气法收集二氧化碳,由于二氧化碳的密度比空气的大,气体应从a端通入,检验二氧化碳已集满的方法是燃着的木条放在a端,木条熄灭,证明已经集满二氧化碳。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】某同学用如图装置验证质量守恒定律。称取一定质量的碳酸钠装入气球,将气球套在锥形瓶上。将药品全部倒入装有足量稀盐酸的锥形瓶中,气球迅速胀大。称量反应前后装置的总质量,实验数据如下表所示。

实验次数 | 1 | 2 | 3 |
碳酸钠质量/克 | 0.53 | 1.06 | 2.12 |
反应前装置总质量/克 | 66.33 | 66.86 | 67.92 |
反应后装置总质量/克 | 66.19 | 66.62 | 67.42 |
(1)计算第1次反应产生的二氧化碳质量为______________。
(2)分析数据发现每次反应前后装置的总质量均不相等,请以第1次反应为例,通过计算说明该反应是否遵循质量守恒定律______________。(空气密度取1.3克/升,二氧化碳密度取2.0克/升,结果精确到0.01)