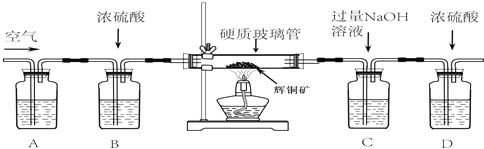
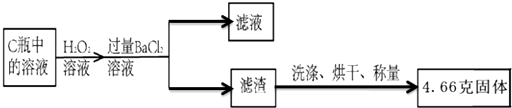
题目内容
8.100mL水和100mL酒精混合,总体积<(填“>”“=”“<”)200mL,这说明分子间有间隔墙内开花墙外香分子是不断运动的.分析 根据分子的基本特征进行分析:分子质量和体积都很小;分子之间有间隔;分子是在不断运动的;结合事实进行分析回答即可.
解答 解:由于分子间有间隔,100mL酒精和100mL水混合后,酒精分子和水分子相互占据空间,所以体积小于200mL
;由于分子是不断运动的,花香的分子通过运动分散到周围的空气中.所以,墙内开花墙外香.
故答为:<,分子间有间隔,分子是不断运动的.
点评 准确理解微观粒子的特征,会用微观的知识来解释生活中的一些现象是解答本题的关键.

练习册系列答案
相关题目


 如图是硫元素在元素周期表中的信息示意图,从中获取的相关信息正确的是A
如图是硫元素在元素周期表中的信息示意图,从中获取的相关信息正确的是A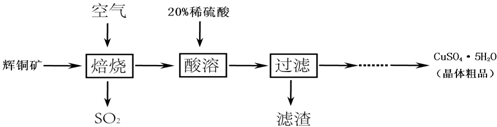
 ,若X等于11,则该微粒表示阳(填“阳”或“阴”)离子.在N、N2、2N2三种符号中,只表示微观意义,而不表示宏观意义的是2N2
,若X等于11,则该微粒表示阳(填“阳”或“阴”)离子.在N、N2、2N2三种符号中,只表示微观意义,而不表示宏观意义的是2N2