题目内容
7.取用粉末固体药品一般用药匙,用过后立即用纸擦干净(防止再取药品时污染药品)取用粉末状药品的步骤:一斜二送三直立(防止粉末状药品粘在试管内壁上).分析 根据取用粉末状固体药品的所需的仪器、操作要领回答本题.
解答 解:在实验室里,取用粉末状固体药品应用药匙,用过后立即用纸擦干净,防止再取药品时污染药品;取用粉末状药品的步骤:一斜二送三直立,以防止粉末状药品粘在试管内壁上.
故答案为:药匙;再取药品时污染药品;粉末状药品粘在试管内壁上.
点评 本题难度不大,考查常见仪器的使用方法,了解常用仪器的使用方法即可正确解答本题.

练习册系列答案
相关题目
17.某校化学课外活动小组在一次活动中,取刚降到地面的雨水水样,每隔5分钟用pH计测定一次pH,其数据如下表:
已知:正常雨水的pH约为5.6,酸雨的pH小于5.6.
(1)所取的雨水是否为酸雨?是(填“是”或“否”);在测定期间,雨水水样的酸性随着时间的变化逐渐增强(填“增强”或“减弱”).
(2)取适量雨水水样加入试管中,在想试管中滴加3-5滴紫色石蕊试液,雨水会变成红色,化学上除了可以用pH计测定pH值外,还可以用pH试纸粗略测定溶液的酸碱度.
(3)经调查,这一地区有一座燃煤发电厂(生产过程中产生SO2),某同学设计用火碱(NaOH)来吸收生产过程中产生的SO2,将其转化成亚硫酸钠(Na2SO3)和水.请你帮他写出该反应的化学方程式:SO2+2NaOH=Na2SO3+H2O.
| 测定时刻 | 6:05 | 6:10 | 6:15 | 6:20 | 6:25 | 6:30 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 |
(1)所取的雨水是否为酸雨?是(填“是”或“否”);在测定期间,雨水水样的酸性随着时间的变化逐渐增强(填“增强”或“减弱”).
(2)取适量雨水水样加入试管中,在想试管中滴加3-5滴紫色石蕊试液,雨水会变成红色,化学上除了可以用pH计测定pH值外,还可以用pH试纸粗略测定溶液的酸碱度.
(3)经调查,这一地区有一座燃煤发电厂(生产过程中产生SO2),某同学设计用火碱(NaOH)来吸收生产过程中产生的SO2,将其转化成亚硫酸钠(Na2SO3)和水.请你帮他写出该反应的化学方程式:SO2+2NaOH=Na2SO3+H2O.
15.下列物质在敞口容器中放置一段时间后,因发生化学变化而使其质量增大的是( )
| A. | 浓硫酸 | B. | 浓盐酸 | C. | 氢氧化钠固体 | D. | 石灰水 |
19.某同学做了如图所示实验:

已知第二次实验中加入的物质均耗尽,且加入的三种溶液中溶质质量分数均为10%.
请回答下列问题:
(1)写出第二次实验中发生反应的化学方程式2NaOH+H2SO4═Na2SO4+2H2O,CuSO4+2NaOH═Na2SO4+Cu(OH)2↓;
(2)第一次实验后溶液中溶质的组成是H2SO4、CuSO4、Na2SO4;
(3)根据已知条件求解第二次实验中生成沉淀的质量(x)的比例式$\frac{160}{40g×10%}$=$\frac{98}{x}$;
(4)实验中每次加入稀硫酸的质量(m)为98g;
(5)若将第二次反应后的固液混合物蒸发掉135.55g水后,再过滤,则所得滤液(不饱和溶液)中溶质的质量分数为17.75%;
(6)若用98%的浓硫酸配制上述实验所需的稀硫酸,则需要浓硫酸和加入水的质量比为5:44.

| 第一次 | 第二次 | |
| 加入稀硫酸的质量 | mg | mg |
| 滴加氢氧化钠溶液的质量 | 60g | 100g |
| 滴加硫酸铜溶液的质量 | 40g | 40g |
| 实验现象 | 无明显现象 | 产生蓝色沉淀 |
请回答下列问题:
(1)写出第二次实验中发生反应的化学方程式2NaOH+H2SO4═Na2SO4+2H2O,CuSO4+2NaOH═Na2SO4+Cu(OH)2↓;
(2)第一次实验后溶液中溶质的组成是H2SO4、CuSO4、Na2SO4;
(3)根据已知条件求解第二次实验中生成沉淀的质量(x)的比例式$\frac{160}{40g×10%}$=$\frac{98}{x}$;
(4)实验中每次加入稀硫酸的质量(m)为98g;
(5)若将第二次反应后的固液混合物蒸发掉135.55g水后,再过滤,则所得滤液(不饱和溶液)中溶质的质量分数为17.75%;
(6)若用98%的浓硫酸配制上述实验所需的稀硫酸,则需要浓硫酸和加入水的质量比为5:44.
 纯碱是一种重要的化工基本原料,工业纯碱中往往会含有少量氯化钠杂质.为测定工业纯碱中碳酸钠的质量分数,某学生设计了如图所示的实验装置:
纯碱是一种重要的化工基本原料,工业纯碱中往往会含有少量氯化钠杂质.为测定工业纯碱中碳酸钠的质量分数,某学生设计了如图所示的实验装置:
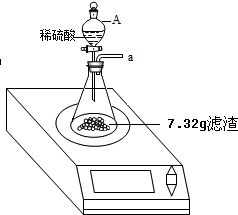 某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.