题目内容
在反应16HCl+2KMnO4=2KCl+2MnCl2+5Cl2↑+8X中,X的化学式为
- A.H2
- B.O2
- C.MnO2
- D.H2O
D
分析:根据质量守恒定律进行分析,化学反应前后元素种类及原子个数不变,分别统计出反应前后原子种类及原子个数,比较分析可得所求物质的化学式.
解答:由质量守恒定律可知,化学反应前后元素种类及原子个数不变,由方程式知,反应物中原子种类及个数为H,16;Cl,16;K,2;Mn,2;O,8;已知生成物中原子种类及个数为K,2;Mn,2;Cl,16;比较分析可知X中含有H和O元素,其原子个数分别为2和1,故X的化学式为:H2O.故A、B、C错误,D正确.
故选D.
点评:本题主要考查学生运用化学式和质量守恒定律计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
分析:根据质量守恒定律进行分析,化学反应前后元素种类及原子个数不变,分别统计出反应前后原子种类及原子个数,比较分析可得所求物质的化学式.
解答:由质量守恒定律可知,化学反应前后元素种类及原子个数不变,由方程式知,反应物中原子种类及个数为H,16;Cl,16;K,2;Mn,2;O,8;已知生成物中原子种类及个数为K,2;Mn,2;Cl,16;比较分析可知X中含有H和O元素,其原子个数分别为2和1,故X的化学式为:H2O.故A、B、C错误,D正确.
故选D.
点评:本题主要考查学生运用化学式和质量守恒定律计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目

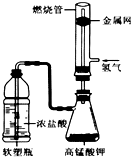 某化学课外活动小组用如图所示的装置制取氯气(Cl2)并模拟盐酸工业合成氯化氢(金属网用以防止气体在燃烧过程中发生爆炸).
某化学课外活动小组用如图所示的装置制取氯气(Cl2)并模拟盐酸工业合成氯化氢(金属网用以防止气体在燃烧过程中发生爆炸). 回答下列问题:
回答下列问题: