题目内容
6.按要求书写下列化学方程式①有铜参加的置换反应2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑.
②有金属生成的非基本类型反应Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
③用磁铁矿炼铁Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2.
④除去铜粉中的铁粉Fe+2HCl═FeCl2+H2↑.
分析 氧化铜在加热条件下能和碳反应生成铜和二氧化碳,属于置换反应;
氧化铁和一氧化碳在高温条件下反应生成铁和二氧化碳,不属于基本反应类型;
磁铁矿的主要成分是四氧化三铁,在高温条件下,四氧化三铁能和一氧化碳反应生成铁和二氧化碳;
铁能和稀盐酸反应生成氯化亚铁和氢气,铜不能和稀盐酸反应.
解答 解:①氧化铜和碳反应的化学方程式为:2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑;
②氧化铁和一氧化碳反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
③四氧化三铁和一氧化碳反应的化学方程式为:Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;
④铁和稀盐酸反应的化学方程式为:Fe+2HCl═FeCl2+H2↑.
故填:2CuO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑; Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2;Fe+2HCl═FeCl2+H2↑.
点评 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
相关题目
14.下列对实验现象的描述中,正确的是( )
| A. | 红磷燃烧时,会产生大量的白雾 | |
| B. | 铁丝在氧气中剧烈燃烧,生成黑色固体 | |
| C. | 木炭在氧气中燃烧时生成黑色固体 | |
| D. | 硫在氧气中燃烧时,会发出淡蓝色火焰 |
18.下列不属于硫燃烧时所产生的现象是( )
| A. | 产生大量白烟 | B. | 放出大量的热 | ||
| C. | 发出蓝色火焰 | D. | 生成有剌激性气味的气体 |
16.“吃得营养,吃出健康”是现代人们普遍的饮食追求,下列有关做法不正确的是( )
| A. | 多吃各种保健品补充微量元素 | |
| B. | 杜绝使用霉变食品 | |
| C. | 天天吃些水果补充维生素 | |
| D. | 用加碘食盐做调味剂防止甲状腺肿大 |

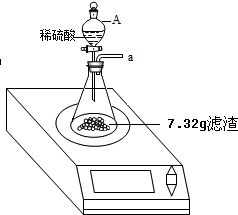 某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
某化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.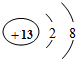 和
和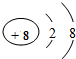 形成的化合物Al2O3.
形成的化合物Al2O3. A、B、C、D分别是硝酸银溶液、碳酸钠溶液、铁粉、稀盐酸中的一种物质.
A、B、C、D分别是硝酸银溶液、碳酸钠溶液、铁粉、稀盐酸中的一种物质.