题目内容
17.同学们利用装修后剩下的大理石碎片进行相关实验.
(1)一位同学设计了装置A制取CO2,该装置能通过上下移动穿过橡胶塞的粗铜丝来控制反应的发生或停止.大理石碎片应放在有孔塑料瓶中,A中反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.根据气体制备的一般原则,A中的粗铜丝不能用铁丝代替,原因是铁能和稀盐酸反应生成氯化亚铁和氢气,造成二氧化碳不纯.
(2)如用装置B干燥CO2,则CO2应从a(填字母)端口通入;若将装置B中的浓H2SO4换成适量澄清石灰水,可用于检验装置A产生的气体,有关反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O.
(3)如用装置C收集CO2,则CO2应从c(填字母)端口通入.
(4)装置D用于通入CO2将水压入量筒中以测量CO2的体积,植物油的作用是隔绝二氧化碳和水,防止二氧化碳溶于水.植物油上方原有的空气对实验的结果没有(填“有”或“没有”) 明显影响.
分析 (1)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,反应不需要加热,大理石和石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;铁能和稀盐酸反应生成氯化亚铁和氢气;
(2)干燥气体时,导管一般遵循长进短出的原则;
(3)二氧化碳的密度比空气大;
(4)二氧化碳能够溶于水.
解答 解:(1)大理石碎片应放在有孔塑料瓶中;A中反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,该反应属于复分解反应;根据气体制备的一般原则,A中的粗铜丝不能用铁丝代替,原因是铁能和稀盐酸反应生成氯化亚铁和氢气.
故填:有孔塑料瓶;CaCO3+2HCl═CaCl2+H2O+CO2↑;复分解;不能;铁能和稀盐酸反应生成氯化亚铁和氢气,造成二氧化碳不纯.
(2)如用装置B干燥CO2,则CO2应从a端口通入.二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,故填:a;CO2+Ca(OH)2=CaCO3↓+H2O;
(3)如用装置C收集CO2,由于二氧化碳的密度比空气大,则CO2应从c端口通入.故填:c.
(4)装置D用于通入CO2将水压入量筒中以测量CO2的体积,植物油的作用是防止二氧化碳溶于水,从而使实验结果更精确.植物油上方原有的空气对实验的结果没有影响;故填:隔绝二氧化碳和水,防止二氧化碳溶于水;没有.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
15.下列实验过程中与图象描述相符的一组是( )
| A. |  两份等质量、等溶质质量分数的双氧水溶液在有无MnO2的情况下产生 | |
| B. |  向一定质量的稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液 | |
| C. |  向等质量的镁、锌中分别加入稀盐酸 | |
| D. |  室温下,向一定质量的饱和石灰水中加入氧化钙 |
16. 如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
 如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )
如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是( )| A. | t1℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲 | |
| B. | t2℃时,20g丙溶解于50g水中能形成70g溶液 | |
| C. | 分别将三种物质的饱和溶液从t3℃降温至t2℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙 | |
| D. | 若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法 |
5.实验室有四瓶失去标签的无色溶液,根据实验室记录,只知道它们分别是氢氧化钡溶液、稀盐酸、碳酸钠溶液、稀硫酸中的一种,在不用其它试剂的情况下,对四瓶溶液进行实验,记录如表:
根据实验现象试推断并写出四种溶液中溶质的化学式.
ABa(OH)2,BNa2CO3,CHCl,DH2SO4.
| A+B | B+D | C+D | A+D |
| 白色沉淀生成 | 气泡产生 | 无明显现象 | 白色沉淀生成 |
ABa(OH)2,BNa2CO3,CHCl,DH2SO4.
2.某化学兴趣小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】(如图1)
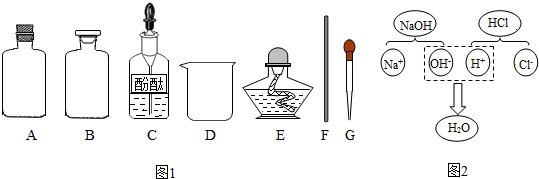
①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
方案③中反应的化学方程式Fe+2HCl=FeCl2+H2↑.上述设计方案中,不正确的是①(填“①”、
“②”或“③”),错误的原因是氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是加入氧化铜或碳酸钠溶液.
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+、OH-结合生成水.
探究Ⅰ:证明氢氧化钠溶液与稀盐酸确实能发生反应.
【方案1】测定稀盐酸与NaOH溶液混合前后的pH.
测定某NaOH溶液的pH,pH大于7.将一定量的稀盐酸加入该NaOH溶液中,混合均匀后测定其pH,发现pH减小了,但仍然大于7,小组中有的同学认为根据这个测定结果可以认为稀盐酸与NaOH溶液发生了反应,你认为他们的结论是否正确:不正确,理由滴加的盐酸中含水,加入后使NaOH溶液变稀,同样会使溶液碱性减弱,pH减小.经过讨论后,他们向溶液中又加入一定量的稀盐酸,混合均匀后测定其pH,pH小于7.
结论:稀盐酸与氢氧化钠溶液发生了化学反应,并且稀盐酸过量.
【方案2】借助于无色酚酞试液.
【药品仪器】(如图1)

①取A(选填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用胶头滴管向①中溶液滴加稀盐酸,红色消失;
③用F蘸取②中溶液,在酒精灯上灼烧,有白色固体产生.
【思考拓展】
(1)如不使用酸碱指示剂,进一步确认步骤③中的白色固体不是氢氧化钠的方法是:取②中溶液,向其中滴加硫酸铜溶液,无蓝色沉淀
(2)探究步骤②中无色溶液中稀盐酸是否过量.
根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,兴趣小组同学又分别选取了AgNO3溶液、紫色石蕊试液、铁粉设计实验方案,请你分析并判断:
| 实验方案 | 实验步骤 | 现 象 | 结 论 |
| ① | 取样,加入适量的AgNO3溶液 | 出现白色沉淀 | 稀盐酸过量 |
| ② | 取样,加入几滴紫色石蕊试液 | 溶液变红 | 稀盐酸过量 |
| ③ | 取样,加入少量铁粉 | 黑色固体溶解,产生气泡,溶液变浅绿色 | 稀盐酸过量 |
“②”或“③”),错误的原因是氯化钠溶液中也含Cl-,与硝酸银溶液反应也会生成白色沉淀.
请你再设计一个与上述实验不同原理的方案以确定稀盐酸是否过量,你选用的试剂是加入氧化铜或碳酸钠溶液.
(3)探究Ⅱ:从微观的角度认识物质及其变化的本质.图2表示氢氧化钠溶液与盐酸反应的微观过程,该反应的本质是H+、OH-结合生成水.
6.人类应合理利用和开发金属资源.
(1)用铜丝做电线是利用了铜的导电性;高压电线一般用铝而不用铜的主要原因是铜的价格比铝高,且密度比较大.
(2)铁是化学性质比较活泼的金属,它在自然界中主要以化合物(填“单质”或“化合物”)的形式存在;在钢铁表面涂油、喷漆、镀铬等,都能防止钢铁生锈.
(3)高炉炼铁的主要反应原理是用一氧化碳还原氧化铁,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)为了探究影响锌与稀硫酸反应剧烈程度的因素,某学习小组用相同的三块锌片进行了以下实验.
对比实验①和②,其目的是探究温度对该反应剧烈程度的影响,则对比实验①和③,目的是探究温度对该反应剧烈程度的影响.
(5)欲验证铝、铁、铜三种金属的活动顺序,若是提供铝丝和铜丝,还需要选择的一种盐溶液是硫酸亚铁溶液.
(1)用铜丝做电线是利用了铜的导电性;高压电线一般用铝而不用铜的主要原因是铜的价格比铝高,且密度比较大.
(2)铁是化学性质比较活泼的金属,它在自然界中主要以化合物(填“单质”或“化合物”)的形式存在;在钢铁表面涂油、喷漆、镀铬等,都能防止钢铁生锈.
(3)高炉炼铁的主要反应原理是用一氧化碳还原氧化铁,反应的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(4)为了探究影响锌与稀硫酸反应剧烈程度的因素,某学习小组用相同的三块锌片进行了以下实验.
| 实验① | 实验② | 实验③ |
 |  |  |
(5)欲验证铝、铁、铜三种金属的活动顺序,若是提供铝丝和铜丝,还需要选择的一种盐溶液是硫酸亚铁溶液.


