题目内容
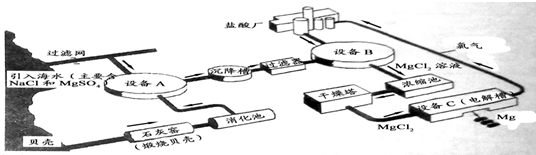
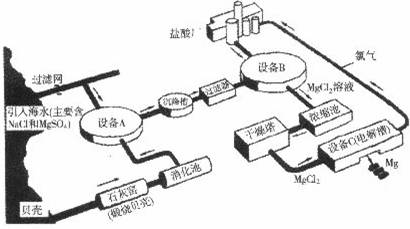
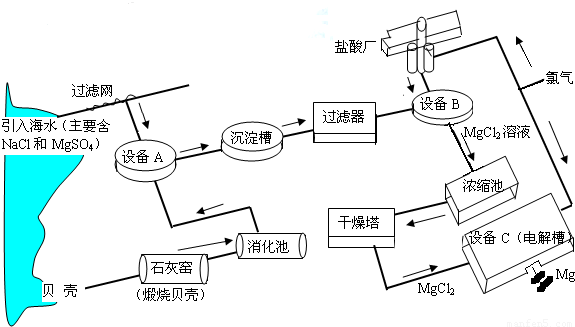
海水中镁的含量一般为1.28g?L-1,总储量约为2×1015t某镁冶炼厂利用海水制镁,其工业流程如下: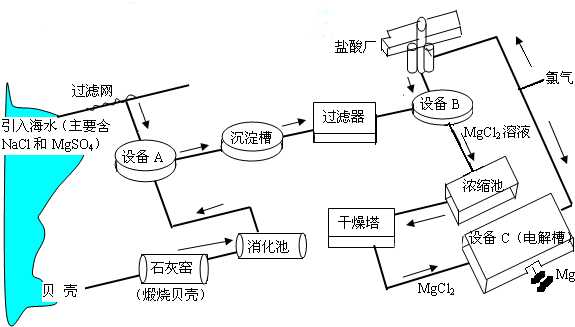
根据上述流程图,回答下列问题:
(1)石灰窑中发生反应的化学方程式为
(2)消化池中发生的反应CaO+H2O═Ca(OH)2,其反应类型为
消化池中温度升高的原因是
(3)写出设备A、B和C中反应的化学方程式
A:
B:
C:
(4)氯气不能排放到空气中,而要循环使用,其原因是:
①
②
分析:根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式;氧化钙溶于水能够放出大量的热;氯气的循环利用可以节约资源;由多种物质反应生成一种物质的反应属于化合反应.
解答:解:(1)石灰窑中发生反应的化学方程式为:CaCO3
CaO+CO2↑.
(2)由CaO+H2O═Ca(OH)2可知,反应物是两种,生成物是一种,属于化合反应.故填:化合反应.
消化池中温度升高的原因是氧化钙溶于水放出大量的热.故填:氧化钙溶于水放出大量的热.
(3)反应的化学方程式为:
A:Ca(OH)2 +MgSO4═Mg(OH)2↓+CaSO4;
B:Mg(OH)2+2HCl═MgCl2+2H2O;
C:MgCl2
Mg+Cl2↑.
(4)氯气不能排放到空气中,而要循环使用,其原因是:
①氯气有毒,排入空气会污染环境;
②可以节约资源.
| ||
(2)由CaO+H2O═Ca(OH)2可知,反应物是两种,生成物是一种,属于化合反应.故填:化合反应.
消化池中温度升高的原因是氧化钙溶于水放出大量的热.故填:氧化钙溶于水放出大量的热.
(3)反应的化学方程式为:
A:Ca(OH)2 +MgSO4═Mg(OH)2↓+CaSO4;
B:Mg(OH)2+2HCl═MgCl2+2H2O;
C:MgCl2
| ||
(4)氯气不能排放到空气中,而要循环使用,其原因是:
①氯气有毒,排入空气会污染环境;
②可以节约资源.
点评:解答本题要充分理解质量守恒定律的内容,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目