题目内容
9.要使一杯硝酸钾不饱和溶液变为饱和溶液,可采取的方法是( )| A. | 不断搅拌 | B. | 加水 | C. | 升高温度 | D. | 加硝酸钾晶体 |
分析 大多数物质的溶解度随着温度的升高而增大,多数物质的不饱和溶液变为饱和溶液,常用的方法有:增加溶质、蒸发溶剂、降低温度,据此进行分析判断.
解答 解:A、不断搅拌,所得溶液仍为硝酸钾的不饱和溶液,故选项错误.
B、加水,硝酸钾的不饱和溶液能继续溶解硝酸钾,所得溶液仍为硝酸钾的不饱和溶液,故选项错误.
C、硝酸钾的溶解度生成温度的升高而增大,升高温度,硝酸钾的溶解度增大,所得溶液仍为硝酸钾的不饱和溶液,故选项错误.
D、加硝酸钾晶体,能使一杯硝酸钾不饱和溶液变为饱和溶液,故选项正确.
故选:D.
点评 本题难度不大,掌握大多数物质不饱和溶液变成饱和溶液一般采取三种方法:增加溶质、恒温蒸发溶剂、改变温度是正确解答本题的关键.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
19.2013年9月23日中国人民银行发行面额为5元硬币,该币正面主景图案为中华人民共和国国徽,内缘上方刊“中华人民共和国”国名、下方刊面额“伍圆”及年号“2013”;背面主景图案为“和”字的行书书法,内缘右上方刊“和”字的五种书法体.甲同学说该币是铜铸的,乙同学说可以用酒精灯灼烧下看是否变黑,就这一过程而言,属于科学研究环节中( )
| A. | 设计实验 | B. | 收集证据 | C. | 建立假设 | D. | 作出结论 |
17.科学探究是奇妙的过程,请你一起参与下列有关过氧化氢溶液制备氧气的探究实验.
(1)问题1 过氧化氢溶液分解速率与催化剂种类有关吗?
在常温下,在相同质量、相同浓度的过氧化氢溶液中,分别加入1g二氧化锰和x g氧化铜,测量各生成一瓶(相同体积)氧气所需的时间.实验数据记录如下:
上述实验中可用排水法收集氧气,理由是氧气不易溶于水,也不与水反应.实验Ⅰ反应的文字表达式是过氧化氢$\stackrel{二氧化锰}{→}$水+氧气,若实验时忘了加入二氧化锰固体,结果是反应速度将减慢.实验Ⅱ中x的值应为1.
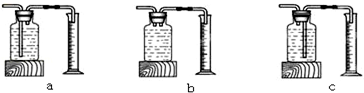
本实验中,与发生装置连接用来测量O2体积的装置可以用图中的c(填编号).
实验结论1:过氧化氢溶液分解速率与催化剂种类有关.
(2)问题2 过氧化氢溶液分解速率与反应物浓度有关吗?
实验数据记录如下:
实验结论2:在相同条件下,双氧水浓度越大,双氧水分解得快.
上述实验中除了量筒外还需用到的测量仪器有天平或秒表(写出其中一种).
(3)影响过氧化氢溶液分解速率可能还与温度有关,请设计实验方案进行验证:
.
(1)问题1 过氧化氢溶液分解速率与催化剂种类有关吗?
在常温下,在相同质量、相同浓度的过氧化氢溶液中,分别加入1g二氧化锰和x g氧化铜,测量各生成一瓶(相同体积)氧气所需的时间.实验数据记录如下:
| 实验编号 | Ⅰ | Ⅱ |
| 反应物 | 5%过氧化氢溶液 | 5%过氧化氢溶液 |
| 催化剂 | 1g 二氧化锰 | x g 氧化铜 |
| 时 间 | 46s | 84s |
本实验中,与发生装置连接用来测量O2体积的装置可以用图中的c(填编号).

实验结论1:过氧化氢溶液分解速率与催化剂种类有关.
(2)问题2 过氧化氢溶液分解速率与反应物浓度有关吗?
实验数据记录如下:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
上述实验中除了量筒外还需用到的测量仪器有天平或秒表(写出其中一种).
(3)影响过氧化氢溶液分解速率可能还与温度有关,请设计实验方案进行验证:
| 实验步骤 | 现 象 | 结 论 |
| 取一支试管加入5mL 15%的过氧化氢溶液.然后把试管放入盛有冷水的烧杯中 | 缓慢有少量气泡冒出 | 温度越高,过氧化氢分解的速率越快 |
| 取一支试管加入5mL 15%的过氧化氢溶液.然后把试管放入盛有热水的烧杯中 | 迅速有大量气泡冒出 |
4.实验室制取氧气的过程如下,正确顺序是( )
①给试管加热;②熄灭酒精灯;③检查气密性;④把高锰酸钾装入试管,在试管口放一小团棉花,用带导管的胶塞塞紧,固定在铁架台上;⑤用排水法收集氧气;⑥从水中取出导管.⑦集气瓶中装满水倒置在水槽中.
①给试管加热;②熄灭酒精灯;③检查气密性;④把高锰酸钾装入试管,在试管口放一小团棉花,用带导管的胶塞塞紧,固定在铁架台上;⑤用排水法收集氧气;⑥从水中取出导管.⑦集气瓶中装满水倒置在水槽中.
| A. | ③④⑦①⑤②⑥ | B. | ③④①⑦⑤⑥② | C. | ③④⑦①⑤⑥② | D. | ④⑦①③⑤⑥② |
1.周一上化学课时,有三位同学来到实验室时,发现一瓶氢氧化钠固体敞放着,这引起了她们的研究欲望.
【提出问题】氢氧化钠固体是否变质?若发生变质,其程度如何?
【查阅资料】(1)氢氧化钠易吸收空气中的二氧化碳而变质,其化学方程式为2NaOH+CO2═Na2CO3+H2O.
(2)氯化钠、氯化钙水溶液显中性,且氯化钙溶液可以与碳酸钠溶液反应,其化学方程式为
CaCl2+Na2CO3═CaCO3↓+2NaCl
【进行猜想】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:该固体全部是NaOH
乙:该固体全部是Na2CO3
丙的猜想是NaOH和Na2CO3
【实验探究】
【进行试验】甲、乙两位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如表,请参与他们的探究并完成所缺内容.
【反思与评价】同学们认真研究实验流程,丙同学认为乙同学设计的方案不合理(填“合理”或“不合理”)其理由是滴加氯化钙溶液,不能保证将碳酸钠完全除去,因此他认为该方案的操作步骤中应改进的是取少量固体,溶于适量水形成溶液后,滴加过量氯化钙溶液,再滴加几滴酚酞试液.
【提出问题】氢氧化钠固体是否变质?若发生变质,其程度如何?
【查阅资料】(1)氢氧化钠易吸收空气中的二氧化碳而变质,其化学方程式为2NaOH+CO2═Na2CO3+H2O.
(2)氯化钠、氯化钙水溶液显中性,且氯化钙溶液可以与碳酸钠溶液反应,其化学方程式为
CaCl2+Na2CO3═CaCO3↓+2NaCl
【进行猜想】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:该固体全部是NaOH
乙:该固体全部是Na2CO3
丙的猜想是NaOH和Na2CO3
【实验探究】
【进行试验】甲、乙两位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体,溶于适量水形成溶液后,滴加过量的盐酸 | 没有明显变化 | 猜想甲不成立 |
| 乙 | 取少量固体,溶于适量水形成溶液后,滴加氯化钙溶液,再滴加几滴酚酞试液 | 生成白色沉淀,酚酞试液变红 | 猜想乙不成立 |
19.下列现象一定说明发生了化学变化的是( )
| A. | 变色 | B. | 冒气泡 | C. | 生成新物质 | D. | 发光、放热 |