题目内容
16. 根据如图自编一道计算题并给出标准的解答过程.
根据如图自编一道计算题并给出标准的解答过程.(原来总是老师出题考我,现在我也当一回老师,并能给出标准的解答过程.)
分析 在编制题目是用上图片中所给的信息.并且在编制时,因要写计算过程,所以编制的题目一定自己能很简单的做出来.
解答 解:根据题给的信息结合所学知识可以知道,题中石灰石可以和稀盐酸反应生成二氧化碳,所以根据该反应可以编制题目为:
足量的盐酸跟125g含碳酸钙80%石灰石完全反应,可生成二氧化碳气体多少克?
解:125g石灰石中含碳酸钙的质量为:125g×80%=100g
设可以生成二氧化碳气体的质量为x,则:
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
100g x
$\frac{100}{100g}=\frac{44}{x}$
解得:x=44g
答:可生成二氧化碳气体44g.
点评 本题通过自编试题的方式来考查学生,充分体现了开放性、自主性,是对学生思考问题的方法和思考、解决问题的过程和考核促进学生从“学会”向“会学”转变.

练习册系列答案
相关题目
3.“墙角数枝梅,凌寒独自开,遥知不是雪,为有暗香来”(王安石《梅花》).诗人在远处就能闻到梅花香味的原因是( )
| A. | 分子很小 | B. | 分子是可分的 | ||
| C. | 分子之间有间隔 | D. | 分子总在不断地运动 |
7.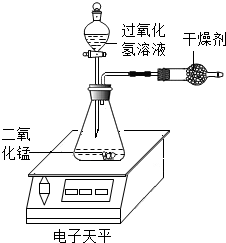 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
[提出问题]哪些因素可能影响该反应的反应速率?
[查阅资料]影响化学反应速率的因素:反应物本身的性质、温度、浓度、催化剂、光、反应物颗粒大小、反应物之间的接触面积和反应物的状态等.
[作出猜想]下面是三位同学所做的猜想,请你完成丙同学的猜想.
甲同学:H2O2溶液的浓度可能影响该反应的反应速率.
乙同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
丙同学:温度可能影响该反应的反应速率.
[实验验证]
(1)如图实验装置,在常温下,每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次电子天平示数减少0.2g所用的时间,记录数据如表:
请你分析回答:
①该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②要比较不同浓度的H2O2溶液对反应速率的影响,可选择的实验编号是3、4(写一组),由此可得到的结论是在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快.
③从上述实验中得出催化剂(MnO2)的用量对反应速率的影响是二氧化锰的用量越多,反应速率越快.达到一定的用量时,速率不在改变
④若撤除干燥管装置,所测速率偏大(选填“偏大”、“偏小”或“不变”).
如果你是丙同学,在验证你的猜想时,你的实验方案是:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间.
[拓展延伸]
(3)如表是甲同学在实验时记录电子天平的示数和对应的时间的一组数据(每隔20s读数一次).
①上表数据分析得出,过氧化氢溶液分解速度的变化情况是逐渐变慢(选填“先快后慢”“先慢后快”“逐渐变慢”),原因是过氧化氢的浓度逐渐减小.
(4)通过该探究实验,你还想探究的问题或还想学习的知识是除MnO2外,是否还有其它物质可作此反应的催化剂.
 某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.
某化学兴趣小组对过氧化氢分解生成水和氧气的条件进行探究,请你参与.[提出问题]哪些因素可能影响该反应的反应速率?
[查阅资料]影响化学反应速率的因素:反应物本身的性质、温度、浓度、催化剂、光、反应物颗粒大小、反应物之间的接触面积和反应物的状态等.
[作出猜想]下面是三位同学所做的猜想,请你完成丙同学的猜想.
甲同学:H2O2溶液的浓度可能影响该反应的反应速率.
乙同学:催化剂(MnO2)的用量可能影响该反应的反应速率.
丙同学:温度可能影响该反应的反应速率.
[实验验证]
(1)如图实验装置,在常温下,每次均取10mL30%的H2O2溶液,然后稀释成不同浓度的溶液进行实验,测定各次电子天平示数减少0.2g所用的时间,记录数据如表:
| 实验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| H2O2溶液浓度 | 5% | 5% | 5% | 10% | 10% | 30% | 30% |
| MnO2粉末(g) | 1.0 | 0.8 | 0.6 | 0.6 | 0.4 | 0.4 | 0.2 |
| 所用的时间(s) | 205 | 205 | 220 | 80 | 90 | 3 | 4 |
①该反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
②要比较不同浓度的H2O2溶液对反应速率的影响,可选择的实验编号是3、4(写一组),由此可得到的结论是在在催化剂、温度等相同的条件下,H2O2溶液的浓度越大,反应越快.
③从上述实验中得出催化剂(MnO2)的用量对反应速率的影响是二氧化锰的用量越多,反应速率越快.达到一定的用量时,速率不在改变
④若撤除干燥管装置,所测速率偏大(选填“偏大”、“偏小”或“不变”).
如果你是丙同学,在验证你的猜想时,你的实验方案是:在MnO2的用量、H2O2溶液的浓度等相同的条件下,控制不同温度,记录收集相同体积的氧气时所用的时间.
[拓展延伸]
(3)如表是甲同学在实验时记录电子天平的示数和对应的时间的一组数据(每隔20s读数一次).
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 | 120 | 140 | 160 | 180 | 200 |
| 示数(g) | 565.40 | 565.37 | 565.34 | 565.30 | 565.28 | 565.26 | 565.24 | 565.23 | 565.22 | 565.21 | 565.20 |
(4)通过该探究实验,你还想探究的问题或还想学习的知识是除MnO2外,是否还有其它物质可作此反应的催化剂.
 A〜H 初中化学常见的物质,已知A为黑色固体单质,B为红色粉末,C和E常温下为气体且均属氧化物,F的浓溶液能挥发出剌激性气味的气体,G-H发生的是化合反应.它们的转化关系如图所示,请回答下列问题:
A〜H 初中化学常见的物质,已知A为黑色固体单质,B为红色粉末,C和E常温下为气体且均属氧化物,F的浓溶液能挥发出剌激性气味的气体,G-H发生的是化合反应.它们的转化关系如图所示,请回答下列问题:
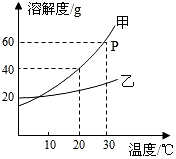 如图是甲、乙两种固体物质的溶解度曲线.据图回答:
如图是甲、乙两种固体物质的溶解度曲线.据图回答:

