题目内容
2. 将100g稀硫酸加入到16g黄铜样品(Cu-Zn合金)中,恰好完全反应,生成氢气的质量与加入稀硫酸的质量关系如图.请计算:
将100g稀硫酸加入到16g黄铜样品(Cu-Zn合金)中,恰好完全反应,生成氢气的质量与加入稀硫酸的质量关系如图.请计算:(1)样品中铜的质量分数.
(2)反应后所得溶液中溶质的质量分数(结果精确到0.1%)
分析 锌与稀硫酸反应生成硫酸锌和氢气,铜不与稀硫酸反应,由生成氢气的质量,由反应的化学方程式列式计算出参加反应的锌的质量、生成硫酸锌的质量,进而计算出样品中铜的质量分数、反应后所得溶液中溶质的质量分数.
解答 解:设参加反应的锌的质量为x,生成硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.2g
(1)$\frac{65}{2}=\frac{x}{0.2g}$ x=6.5g
样品中铜的质量分数为$\frac{16g-6.5g}{16g}$×100%≈59.4%.
(2)$\frac{161}{2}=\frac{y}{0.2g}$ y=16.1g
反应后所得溶液中溶质的质量分数为$\frac{16.1g}{6.5g+100g-0.2g}×$100%≈15.1%.
答:(1)样品中铜的质量分数为59.4%;
(2)反应后所得溶液中溶质的质量分数为15.1%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
12.下列化学反应现象描述正确的是( )
| A. | 木炭在氧气中燃烧时,放出大量的热,生成二氧化碳气体 | |
| B. | 红磷在氧气中燃烧时,放出大量的热,产生大量白色烟雾 | |
| C. | 铁丝在氧气中燃烧时,火星四射,产生一种红棕色的固体 | |
| D. | 水通电一段时间后,阴极与阳极产生的气体体积比约为2:1 |
1.有三瓶失去标签的无色无味气体:氮气、氧气、空气.请你选择一种最简便的方法将他们区分开来.( )
| A. | 带火星的木条 | B. | 铁丝燃烧 | C. | 燃着的木条 | D. | 红磷燃烧 |
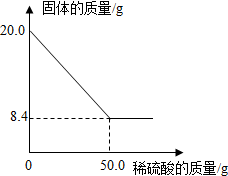 菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.
菱铁矿(主要成分是FeCO3)是炼铁的原料.现取20.0g菱铁矿,向其中加入足量稀硫酸,充分反应,测得固体质量与所加稀硫酸的质量关系如图所示.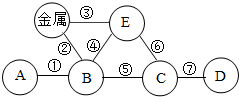 构建知识网络是化学学习中的常用方法.下图是某同学在复习“我们身边的化学物质”时构建的知识网络,其中A、B、C、D、E分别表示非金属氧化物、金属氧化物、酸、碱、盐中的某一种,“-”表示物质之间普遍能够发生的化学反应.
构建知识网络是化学学习中的常用方法.下图是某同学在复习“我们身边的化学物质”时构建的知识网络,其中A、B、C、D、E分别表示非金属氧化物、金属氧化物、酸、碱、盐中的某一种,“-”表示物质之间普遍能够发生的化学反应.