题目内容
有一包粉末,已知由CaCO3、FeCl3、MgCl2、Na2SO4、NaOH、NaNO3中的几种组成.为确定其组成,现进行以下实验,各步骤均已充分反应.
①取一定质量的粉末,加水搅拌后过滤,得到沉淀和无色溶液A;
②向①步得到的沉淀中加入足量稀盐酸,得到无色气体和黄色溶液;
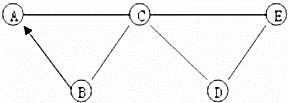
③将①步得到的无色溶液A进行如图所示的实验.
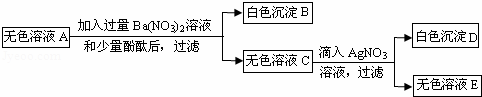
请回答下列问题:
(1)B的化学式是 .
(2)A中一定存在的溶质的化学式是 .
(3)生成白色沉淀D的化学方程式是 .
(4)这包粉末中可能含有物质的化学式是 .
考点:
物质的鉴别、推断;碱的化学性质;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
专题:
混合物组成的推断题.
分析:
①根据碳酸钙难溶于水、氯化铁溶液显黄色、氯化铁和氢氧化钠会生成氯化钠和红褐色的氢氧化铁沉淀、氯化镁和氢氧化钠会生成氯化钠和白色的氢氧化镁沉淀可知,原粉末中可能含有CaCO3、FeCl3、MgCl2、NaOH;
②根据碳酸钙与稀盐酸反应生成无色气体二氧化碳,氢氧化铁与稀盐酸反应会生成氯化铁的黄色溶液可知,原粉末中一定含有CaCO3、FeCl3、NaOH;
③根据硫酸钠和硝酸钡反应生成硝酸钠和硫酸钡沉淀,①步得到的无色溶液A中含有的氯化钠和硝酸银反应生成硝酸钠和氯化银沉淀等知识进行分析.
解答:
解:通过分析可知:
(1)由于硫酸钠和硝酸钡反应生成硝酸钠和硫酸钡沉淀,所以B的化学式是:BaSO4.
(2)向①步得到的沉淀中加入足量稀盐酸,得到无色气体和黄色溶液,说明沉淀中含有碳酸钙和氢氧化铁,说明原物质中含有的碳酸钙、氯化铁、氢氧化钠已不在A中,若原物质中含有氯化镁也已形成氢氧化镁沉淀,而硝酸钠不影响本题的现象,故A中一定存在的溶质的化学式是:Na2SO4、NaCl.
(3)氯化钠和硝酸银反应生成硝酸钠和氯化银沉淀,生成白色沉淀D的化学方程式是:NaCl+AgNO3═AgCl↓+NaNO3.
(4)MgCl2和NaNO3是否存在对本题的现象没有明显的影响,所以这包粉末中可能含有物质的化学式是:MgCl2、NaNO3.
故答案为:
(1)BaSO4.
(2)Na2SO4、NaCl.
(3)NaCl+AgNO3═AgCl↓+NaNO3.
(4)MgCl2、NaNO3.
点评:
根据物质的性质及变化规律,结合转化变化框图中的实验现象,确定固体中一定含有的物质与一定不含有的物质,然后对可能含有的物质进行组合.

下列物质常用于改良酸性土壤的是( )
|
| A. | 熟石灰 | B. | 烧碱 | C. | 食盐 | D. | 大理石 |
甲、乙、丙、丁四种物质的相互反应关系如图所示(“﹣”表示相连的物质间能发生反应)下列符合对应反应关系的选项是( )
| 选项 | A | B | C | D |
|
| 物 质 | 甲 | Ca(OH)2 | CO2 | H2 | Fe |
| 乙 | Na2CO3 | NaOH | O2 | HCl | |
| 丙 | H2SO4 | CaCl2 | CuO | CuSO4 | |
| 丁 | BaCl2 | AgNO3 | HCl | NaOH |
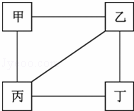
|
| A. | A | B. | B | C. | C | D. | D |
下列说法正确的是( )
|
| A. | 用水区分氯化铁,氯化钠,硝酸钾三种晶体 |
|
| B. | 无色透明的液体都为溶液 |
|
| C. | 品红在水中扩散,说明分子在不断运动 |
|
| D. | 海水晒盐是化学变化 |