题目内容
甲醇(CH3OH)是一种有毒、有酒的气味的可燃性液体。甲醇在氧气中不完全燃烧可发生如下反应:8CH3OH+ nO2
nO2 m
m CO2+2CO+16H2O。若反应生成3.6 g水,请计算:
CO2+2CO+16H2O。若反应生成3.6 g水,请计算:
(1)m的值是 。
(2)参加反应的氧气质量是多少克?( 写出规范计算步骤)
写出规范计算步骤)
答案 【解析】质量守恒定律不仅体现在宏观上总质量相等、元素的质量相等,还体现在微观上原子个数相等。根据碳原子数反应前后相等,8=m+2,m=6;反应前后氧原子个数为8+2n=6×2+2+16,n=11,然后根据化学方程式,由生成3.6 g水,求参加反应的氧气的质量。
答案:(1)6
(2)8+2n=6×2+2+16 n=11
设参加反应的氧气质量为x
8C H3OH+11O2
H3OH+11O2 6CO2+2CO+16H2O
6CO2+2CO+16H2O
11×32 16×18
=352 = 288
288
x 3.6 g
 =
=
x=4.4 g
答:参加反应的氧气为4.4 g。

练习册系列答案
相关题目

 题。
题。 __。
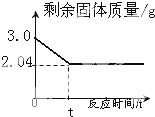
__。
 g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质的质量变为159.4g。求:⑴反应生成二氧化碳的质量;⑵石灰石中含碳酸钙的质量分数。
g稀盐酸的烧杯中,石灰石中的碳酸钙与盐酸恰好完全反应(杂质不反应,也不溶解),烧杯内物质的质量变为159.4g。求:⑴反应生成二氧化碳的质量;⑵石灰石中含碳酸钙的质量分数。
 C5H8O2
C5H8O2 
 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑ 2H2O进行描述(各答出一项即可):
2H2O进行描述(各答出一项即可):