题目内容
20.按要求回答下列问题:(1)“化学使天更蓝,水更清”.汽车尾气处理装置能使某些有毒气体转化为无毒气体:反应的化学方程式:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$X+2CO2,X的化学式N2.
(2)“物质的性质与其用途密切相关”.例如:铜用于制作导线是因为其具有良好的延展性和导电性;一氧化碳的性质决定了一氧化碳在钢铁冶炼中的作用,请你用化学方程式表示高炉炼铁的原理3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
(3)目前人类以化石燃料为主要能源,常见的化石燃料包括煤、石油和天然气;为减少污染,提高煤的利用率,可将其转化为可燃性气体,此过程可认为是碳和水的反应,其微观示意图如下所示:

该反应的基本类型为置换反应,生成物C和D的分子个数比为1:1.
分析 (1)根据质量守恒定律的实质可以知道:化学反应前后原子的种类和数目不变,可以据此结合题给的化学方程式求出R的化学式;
(2)铜用于制作导线是因为其具有良好的延展性和导电性;高炉炼铁的原理是在高温的条件下,一氧化碳把铁从铁矿石里还原出来;
(3)根据化石燃料的种类分析回答;
根据反应的微观示意图,分析反应的特点.判断反应的类型;
根据反应的微观示意图及质量守恒定律分析反应生成物的分子个数比.
解答 解:(1)从题给的化学方程式2CO+2NO $\frac{\underline{\;催化剂\;}}{\;}$2CO2+X,可以知道:反应前原子的种类和个数为:2个碳原子,4个氧原子,2个氮原子;而反应后出现的原子种类和个数为:2个碳原子,4个氧原子.所以根据质量守恒定律的反应前后原子的种类和数目相等,可以知道,X中含有2个氮原子,故其化学式为:N2.;
(2)铜用于制作导线是因为其具有良好的延展性和导电性;高炉炼铁的原理是在高温的条件下,一氧化碳把铁从铁矿石里还原出来,化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(3)常见的化石燃料包括煤、石油和天然气;
由反应的微观示意图可知,该反应由一种单质和化合物反应,生成了另一种单质和另一种化合物,属于置换反应;
由反应的微观示意图及质量守恒定律可知,该图示中一个碳原子与一个水分子反应,生成了一个易氧化碳分子和一个氢分子,所以,该反应生成物的分子个数比为1:1.
故答案为:(1)N2;
(2)导电;3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)天然气;置换;1:1;
点评 完成此题,可以依据已有的知识进行,要求同学们加强基础知识的储备,以便灵活应用.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案| A. | 熟石灰 | B. | 硝酸铵 | C. | 苛性钠 | D. | 生石灰 |
 碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.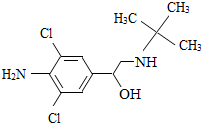 今年年初双汇火腿系列产品由于“瘦肉精”问题受到国家质检总局及相关部门联合彻查,瘦肉精学名盐酸克伦特罗;是一种平喘药.该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂.盐酸双氯醇胺;克喘素;氨哮素;氨必妥;氨双氯喘通;氨双氯醇胺. 它的理化特性:白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.盐酸克伦特罗结构简式.
今年年初双汇火腿系列产品由于“瘦肉精”问题受到国家质检总局及相关部门联合彻查,瘦肉精学名盐酸克伦特罗;是一种平喘药.该药物既不是兽药,也不是饲料添加剂,而是肾上腺类神经兴奋剂.盐酸双氯醇胺;克喘素;氨哮素;氨必妥;氨双氯喘通;氨双氯醇胺. 它的理化特性:白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.盐酸克伦特罗结构简式.