题目内容
10.金属在生产和生活中起重要作用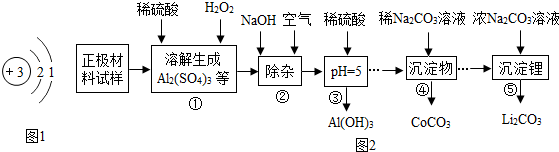
Ⅰ.金属锂在新能源开发中占有重要地位
(1)锂(Li)原子结构示意图如图1所示,Li在化学反应中容易失(填“得”或“失”)电子,它的离子符号为Li+.
(2)LiOH和NaOH都属于碱,它们的水溶液解离出相同的OH-(填“H+”或“OH-”).
Ⅱ.废旧锂电池主要回收是正极材料,其主要成分为钴酸锂(LiCoO2)、铝箔等,回收工艺流程如图2:
(3)从流程图可得:回收的产物除了有Li2CO3,还有Al(OH)3(写一种).
(4)步骤③中,溶液呈酸性(填“酸性”、“中性”或“碱性”)
(5)写出步骤①中稀硫酸溶解铝箔(Al)的化学方程式2Al+3H2SO4=Al2(SO4)3+3H2↑.
分析 (1)根据锂原子最外层电子数特点分析得失电子情况,并书写离子符号;(2)根据碱的概念分析回答;(3)根据流程图中的产物回答;(4)根据步骤③溶液的pH值分析回答;(5)根据铝与稀硫酸反应生成硫酸铝和氢气书写化学方程式.
解答 解:(1)锂原子最外层有1个电子,电子个数小于4在化学变化中易失去电子,而形成带1个单位正电荷的锂离子,故填:失;Li+;
(2)碱是由金属阳离子或铵根离子和氢氧根离子构成的化合物,碱的水溶液中能离解出氢氧根离子,故填:OH-;
(3)由题中流程图可以看出在整个生产过程中共生成了三种物质:氢氧化铝、碳酸钴、碳酸锂,所以除了碳酸锂外另外两种也是可回收的产生,故填:Al(OH)3或CoCO3;
(4)由步骤③时溶液pH等于5可知此时溶液显酸性,故填:酸性;
(5)铝和稀硫酸反应生成硫酸铝和氢气,据此书写化学方程式,故填:2Al+3H2SO4=Al2(SO4)3+3H2↑.
点评 本题为生产流程题,涉及金属的回收、化学方程式的书写等知识,较为综合,解题的关键在于能看懂流程图,从中获取相关信息.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 可用熟石灰改良酸性土壤 | |
| B. | 晚上天然气泄露,应立即开灯查找原因 | |
| C. | 不能用燃烧的方法区分羊毛和涤纶 | |
| D. | 食用加碘盐可补充常量元素碘 |
1.逻辑推理是化学学习常用的思维方法,下列推理正确的是( )
| A. | 水能灭火,所以家用电器一旦失火应立即用水浇灭 | |
| B. | 原子在化学变化中不能再分,则分子在化学变化中也不能再分 | |
| C. | 点燃可燃性气体与O2混合气体可能爆炸,则点燃CO与O2的混合气体也可能爆炸 | |
| D. | 氧化物都含有氧元素,所以含有氧元素的化合物都是氧化物 |
18.泸州又称酒城,盛产白酒.根据物质的分类方法,判断白酒属于( )
| A. | 单质 | B. | 化合物 | C. | 氧化物 | D. | 混合物 |
5.在密闭,隔热的条件下,向装有水的保温瓶中加入某种物质,溶液温度下降,则这种物质可能是( )
| A. | 蔗糖 | B. | 硝酸铵 | C. | 氯化钠 | D. | 氢氧化钠 |
19.类推是常用的思维方法.以下类推正确的是( )
| A. | 分子可以构成物质,所以物质一定由分子构成 | |
| B. | 燃烧一定会发光放热,所以发光放热的变化一定是燃烧 | |
| C. | 催化剂能改变物质的化学反应速率,所以能改变物质的化学反应速率的一定是催化剂 | |
| D. | 氧化反应是物质与氧发生的反应,所以物质与氧气发生的反应一定是氧化反应 |

