题目内容
10.下列实验操作正确的是( )| A. | 过滤时滤纸边缘高于漏斗口 | |
| B. | 用天平称量时,药品放在右盘 | |
| C. | 没有说明用量,取用液体药品的体积一般为1-2mL | |
| D. | 将吸取液体后的胶头滴管平放或倒置,以防液体流出 |
分析 A、过滤是实验基本操作之一,过滤的要点是:一贴、二低、三靠.
B、根据托盘天平的使用要遵循“左物右码”的原则进行分析判断;
C、根据节约药品考虑;
D、根据药品具有腐蚀性考虑.
解答 解:
A、滤纸边缘稍高于漏斗口时,会进入气泡,影响过滤,故操作错误;
B、托盘天平的使用要遵循“左物右码”的原则,应将将药品放在天平左盘中称量,故操作错误;
C、没有说明用量时,取用液体药品的体积一般为1-2mL,故操作正确;
D、将吸取液体后的胶头滴管平放或倒置,会腐蚀胶头,故操作错误.
故选C.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.化学是以实验为基础的学科,掌握正确的化学实验操作是学好化学的关键.

练习册系列答案
相关题目
20.小明家的水稻出现了叶子发黄、发育迟缓其易倒伏现象,应施用的肥料是( )
| A. | CO(NH2)2 | B. | KCl | C. | Ca(H2PO4)2 | D. | KNO3 |
1.鉴别下列各组物质,所用试剂不正确的是( )
| 选项 | 待鉴别的物质 | 鉴别试剂 |
| A | 铜和黄铜 | 稀盐酸 |
| B | 海水和蒸馏水 | 硝酸银溶液 |
| C | 澄清的石灰水和氢氧化钠溶液 | 二氧化碳 |
| D | 碳酸钠溶液和氢氧化钠溶液 | 无色酚酞试液 |
| A. | A | B. | B | C. | C | D. | D |
18.分类是学习和研究化学的常用方法.下列分类中正确的是( )
| A. | 有机物:甲烷、乙醇、葡萄糖 | |
| B. | 复合肥料:尿素、硝酸钾、磷酸氢二铵 | |
| C. | 混合物:煤、石油、冰水共存物 | |
| D. | 合成材料:合金、合成橡胶、合成纤维 |
15.现有Na、O、C、H四种元素中,请选用其中一种或几种元素写出符合下列要求的化学式各写一个:
(1)最理想的燃料H2;
(2)空气中体积分数占第二位的气体O2;
(3)汽水中含有的不稳定的酸H2CO3.
(1)最理想的燃料H2;
(2)空气中体积分数占第二位的气体O2;
(3)汽水中含有的不稳定的酸H2CO3.
2.以下四组离子,有一组能大量共存且能形成无色透明溶液,它应该是( )
| A. | Fe3+ SO42- H+ Cl- | B. | Mg2+ Cl- OH- Na+ | ||
| C. | H+ Na+ K+ NO3- | D. | H+ Ba2+ NO3- SO42- |
19.下列物质可以由金属与酸反应制得的是( )
| A. | 氯化银 | B. | 硫酸锌 | C. | 氯化铁 | D. | 硫酸铜 |
20.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开始探究活动.以下是教学片断,请你参与学习并帮助填写空格(包括表中空格).
【查阅资料】Na2SO4溶液呈中性
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
Ⅰ.定性探究
【提出问题】反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,你认为不合理的猜想是哪种并说出理由猜想四H2SO4和NaOH在溶液中不能共存.
【继续试验】(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴酚酞溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,丙选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,分别进行如下三组探究实验.
【得出结论】通过探究,全班同学一直确定猜想二是正确的.
【评价反思、老师对同学能用多种方法进行探究,并且得出正确结论给予肯定,同时也指出上述三个实验探究中也有一个是不合理的,这个方案是③(选填①、②、③),你还可以选择锌粒(填药品名称)进行实验,也能得出同样的结论.
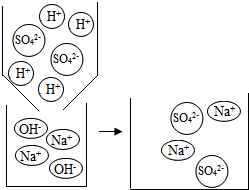
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在反应后的方框中补画未画全的微粒.
Ⅰ.定量探究
取上述【演示实验】反应后烧杯中的溶液100g,设计如下实验:
试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)
【查阅资料】Na2SO4溶液呈中性
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
Ⅰ.定性探究
【提出问题】反应后溶液中溶质是什么呢?
【猜想】针对疑问大家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的,你认为不合理的猜想是哪种并说出理由猜想四H2SO4和NaOH在溶液中不能共存.
【继续试验】(1)丙组同学取烧杯中的少量溶液于试管中,滴加几滴酚酞溶液,无明显变化,溶液中一定没有NaOH或氢氧化钠.
(2)为了验证其余猜想,各组同学取烧杯中的溶液,丙选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,分别进行如下三组探究实验.
| 实验方案 | ①测溶液pH | ②滴加Na2CO3溶液 | ③滴加BaCl2溶液 |
| 实验现象 | 试纸变色,与标准比色卡比照,得pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思、老师对同学能用多种方法进行探究,并且得出正确结论给予肯定,同时也指出上述三个实验探究中也有一个是不合理的,这个方案是③(选填①、②、③),你还可以选择锌粒(填药品名称)进行实验,也能得出同样的结论.
【剖析本质】实验后,老师又带领大家从微观的角度来理解此反应的实质,请你和同学们一起在反应后的方框中补画未画全的微粒.

Ⅰ.定量探究
取上述【演示实验】反应后烧杯中的溶液100g,设计如下实验:

试计算上述【演示实验】反应后溶液中Na2SO4的质量分数是多少?(列出计算过程)