题目内容
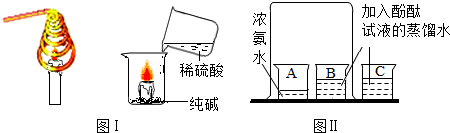
20.图为某工厂利用粗盐水生产纯碱的工艺流程图.
①下列说法正确的是BD(填字母).
A.流程Ⅰ中加入溶液的顺序不能改变
B.流程Ⅰ将粗盐水中的 SO42-、Mg2+、Ca2+转化为沉淀
C.流程Ⅰ后过滤得到三种沉淀
D.流程Ⅲ中发生的是分解反应
②流程 II 中发生的主要反应为:NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl.20℃时,向 100g 水中加入 11.7g NaCl 和 15.8g NH4HCO3,充分反应后,理论上从溶液中析出晶体的质量为7.1 g(20℃时,NaHCO3的溶解度为 9.7g,NH4Cl 的溶解度为 37.2g).
分析 ①根据加入氯化钡溶液可以除去硫酸钠,加入氢氧化钠可以除去氯化镁,加入碳酸钠溶液可以除去氯化钙和过量的氯化钡;加热碳酸氢钠分解进行分析解答;
②根据11.7g的NaCl或15.8g的NH4HCO3,进行化学方程式计算,求得生成NaHCO3的质量,进而求出实际上从溶液中析出NaHCO3的固体质量.
解答 解:①A、加入三种溶液的顺序可以调整为:先加入过量的氢氧化钠溶液除去氯化镁,再加入过量的氯化钡溶液除去硫酸钠,最后加入过量的碳酸钠溶液除去氯化钙和过量的氯化钡,故A错误;
B、加入三种溶液能够将粗盐水中的SO42-、Mg2+、Ca2+转化为沉淀硫酸钡、氢氧化镁和碳酸钙,故B正确;
C、按流程I所加溶液的顺序除杂,过滤后得到四种沉淀,它们是硫酸钡、氢氧化镁、碳酸钙和碳酸钡,故C错误;
D、流程Ⅲ中发生的是碳酸氢钠分解为碳酸钠、水和二氧化碳,属于分解反应,故D正确.
故选:BD;
②设理论上生成的碳酸氢钠质量为x
NaCl+NH4HCO3═NaHCO3↓+NH4Cl
58.5 84
11.7g x
$\frac{58.5}{84}=\frac{11.7g}{x}$
x=16.8g
实际析出NaHCO3固体的质量为:16.8g-9.7g=7.1g.
故答案为:①BD;
②7.1.
点评 本题难度比较大,涉及粗盐提纯的原理、除杂的原理、侯氏制碱法的原理等理论内容,要通过该题认真总结解题思路.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.钛和钛合金被认为是21世纪的重要金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等.已知钛原子的原子序数为22,中子数为26,则钛原子的核外电子数为( )
| A. | 48 | B. | 22 | C. | 26 | D. | 4 |
12. 请根据表中物质回答下列有关问题.
请根据表中物质回答下列有关问题.
①选用表中的物质作为反应物,写出制取氢氧化钠的化学方程式:Ca(OH)2+Na2CO3=2NaOH+CaCO3↓.
②某澄清溶液由HNO3、Na2SO4、K2CO3、CuCl2四种物质中的两种组成,向溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量(m)与加入Ba(OH)2溶液的体积(V)的关系如图所示.则该溶液所含的溶质是HNO3、CuCl2.
 请根据表中物质回答下列有关问题.
请根据表中物质回答下列有关问题.| 序号 | ① | ② | ③ | ④ |
| 物质 | 醋酸 | 氧化铁 | 熟石灰 | 纯碱 |
②某澄清溶液由HNO3、Na2SO4、K2CO3、CuCl2四种物质中的两种组成,向溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量(m)与加入Ba(OH)2溶液的体积(V)的关系如图所示.则该溶液所含的溶质是HNO3、CuCl2.
 如图表示的是甲、乙两种固体物质的溶解度曲线.①30℃质量相等的甲、乙两饱和溶液降温到10℃时,甲溶液的质量小于乙溶液的质量(填“大于”或“等于”或“小于”);若甲中含有少量乙,应用降温结晶法提纯.
如图表示的是甲、乙两种固体物质的溶解度曲线.①30℃质量相等的甲、乙两饱和溶液降温到10℃时,甲溶液的质量小于乙溶液的质量(填“大于”或“等于”或“小于”);若甲中含有少量乙,应用降温结晶法提纯.
