题目内容
12.工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,现将黄铁矿粉碎,然后按照以下流程制备硫酸: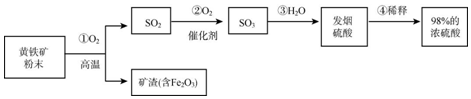
(1)先将黄铁矿石粉碎的目的是增大与氧气的接触面积,使之充分反应.
(2)将10g98%的浓硫酸稀释成9.8%的稀硫酸,需要加水90g.
(3)取20g矿渣样品(含Fe2O3),向其中加入300g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数.
分析 (1)根据反应物接触面积越大,反应越快考虑;(2)根据加水前后溶质质量不变考虑;(3)根据硫酸的质量计算出氧化铁的质量,再除以样品的质量.
解答 解:(1)将黄铁矿石粉碎,增大与氧气的接触面积,使之充分反应;故填:增大与氧气的接触面积,使之充分反应;
(2)设需要加水的质量为X,则:10g×98%=(10g+X)×9.8%,解得X=90g;故填:90;
(3)300g9.8%的稀硫酸中含H2SO4的质量是:300g×9.8%=29.4g,设氧化铁的质量为x
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
160 294
x 29.4g
$\frac{160}{294}=\frac{x}{29.4g}$
x=16g,
$\frac{16g}{20g}$×100%=80%
答:该矿渣样品中氧化铁的质量分数为80%.
点评 解答本题关键是要知道浓硫酸加水稀释时溶质质量不变,熟悉根据化学方程式的简单计算,并能灵活运用.

练习册系列答案
相关题目
7. 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水)( )| A. | 从N→M:先向N中加入适量固体A再降温 | |
| B. | 从N→M:先将N降温再加入适量固体A | |
| C. | 从M→N:先将M降温过滤后再将其升温 | |
| D. | 从M→N:先将M升温再将其蒸发掉部分水 |
17.下列有关化学实验中的说法正确的是( )
| A. | 纯碱溶液能使酚酞试液变红色,故纯碱使用后应放回到碱类柜子内存放 | |
| B. | 称量氢氧化钠固体时,必须将所称药品放在托盘天平左盘上的洁净的纸上,进行称量 | |
| C. | 四种白色固体氯化钠、氯化钡、无水硫酸铜、硫酸钠,只用水是不能把它们区分开的 | |
| D. | 浓硫酸和NaOH固体都可以干燥氧气和氮气 |
1.逻辑推理是化学学习常用的思维方法.下列推理正确的是( )
| A. | 酸溶液的pH都小于7,所以pH小于7 的一定是酸溶液 | |
| B. | 单质中只含一种元素,所以含一种元素的物质一定是单质 | |
| C. | 化合物是由不同种元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物 | |
| D. | 中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应 |

 用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示:
用某浓度的稀盐酸溶液50克和10%的氢氧化钠溶液进行反应时,反应过程中溶液的酸碱度变化如图所示: