题目内容
11.科学家设想利用太阳能加热器“捕捉CO2”“释放CO2”,实现碳循环(如图所示).
(1)完善步骤1的化学方程式:CaO+CO2$\frac{\underline{\;400℃\;}}{光照}$CaCO3.
(2)为确定步骤2中的碳酸钙是否完全溶解.设计的实验步骤为:取少量固体于试管中,滴加过量稀盐酸溶液,若观察到试管内有气泡产生,则分解不完全.
(3)上述设想的优点有AB(填字母)
A.原料易得且可循环利用 B.充分利用太阳能 C.全地域全天候使用
(4)CO2是宝贵的碳氧资源,和CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2和H2的分子个数比为1:1.
分析 (1)根据反应物、生成物和条件书写方程式;
(2)从碳酸盐检验方法去分析解答;
(3)A.上述设想中的原料是二氧化碳、氧化钙,原料易得,反应过程中二氧化碳和氧化钙既是步骤1的反应物,又是步骤2的生成物,可以循环使用去分析解答;
B.反应的反应条件是光照和加热,太阳能也能提供热量去分析解答;
C.从遮光的地方及阴天没有太阳时就不能反应去分析解答;
(4)二氧化碳和氢气在一定条件下反应生成甲酸,根据反应的化学方程式可以判断反应物中的分子个数比.
解答 解:
(1)用化学方程式表示使空气中CO2含量减少的原因是CaO+CO2$\frac{\underline{\;400℃\;}}{光照}$CaCO3;
(2)碳酸钙属于碳酸盐,碳酸盐的检验可加入稀盐酸,如果有二氧化碳气体产生,说明含有碳酸盐;故答案为:稀盐酸;有气泡产生;
(3)
A.上述设想中的原料是二氧化碳、氧化钙,原料易得,反应过程中二氧化碳和氧化钙既是步骤1的反应物,又是步骤2的生成物,可以循环使用故正确;
B.反应的反应条件是光照和加热,太阳能也能提供热量;故正确;
C.遮光的地方及阴天没有太阳时就不能反应;故错误;
(4)CO2和H2在一定条件下可合成甲酸,反应的化学方程式为:CO2+H2$\frac{\underline{\;一定条件\;}}{\;}$HC00H,因此反应中CO2与H2的分子个数比是1:1.
故答案为:
(1)CaO+CO2$\frac{\underline{\;400℃\;}}{光照}$CaCO3;
(2)稀盐酸;有气泡产生;
(3)AB;
(4)1:1.
点评 本题考查了二氧化碳的有关性质及方程式的书写,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
1.分类是学习和研究化学的常用方法.下列物质分类不正确的是( )
| A. | 有机物:甲烷 | B. | 碱:纯碱 | C. | 混合物:自来水 | D. | 氧化物:水 |
2.某有机物燃烧的化学方程式:X+5O2$\stackrel{点燃}{→}$3CO2+4H2O,有机物X的化学式是( )
| A. | C3H8 | B. | C3H6 | C. | C3H8O2 | D. | C3H6O |
6.肉桂酸的分子式为C9H8O2,关于肉桂酸的说法正确的是( )
| A. | 有3种元素组成 | B. | 摩尔质量为148 | ||
| C. | 氧元素的质量分数最少 | D. | 1mol分子中含有19个原子 |
16.临近中考,妈妈为了给小丽增加营养,制定了午餐,食谱如下:米饭、炸鸡腿、清蒸鱼、鸡蛋汤,你建议小丽的妈妈还应该增加的食物是( )
| A. | 青菜 | B. | 牛奶 | C. | 炒花生 | D. | 玉米 |
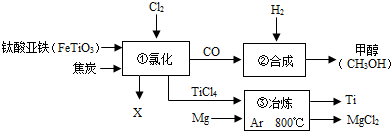
 A--H是初中化学常见的物质,它们能相互转化关系如图所示,图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件为标出).已知D是人体中含量最多的物质,F可用于改良酸性土壤,且与G属于同类
A--H是初中化学常见的物质,它们能相互转化关系如图所示,图中“→”表示转化关系,“-”表示相互能反应(部分物质和反应条件为标出).已知D是人体中含量最多的物质,F可用于改良酸性土壤,且与G属于同类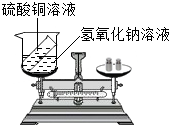 某兴趣小组为了验证质量守恒定律,在烧杯中盛有20g溶质质量分数为20%的氢氧化钠溶液试管内装有20g硫酸铜溶液,如图所示,放于天平上称量,此时天平平衡.然后将试管内药品倒入烧杯内(试管不取出),恰好完全反应,试根据要求,回答下列问题:
某兴趣小组为了验证质量守恒定律,在烧杯中盛有20g溶质质量分数为20%的氢氧化钠溶液试管内装有20g硫酸铜溶液,如图所示,放于天平上称量,此时天平平衡.然后将试管内药品倒入烧杯内(试管不取出),恰好完全反应,试根据要求,回答下列问题: