题目内容
【题目】溶液与人们的生产生活密切相关,图I为甲、乙、丙三种固体物质的溶解度曲线。
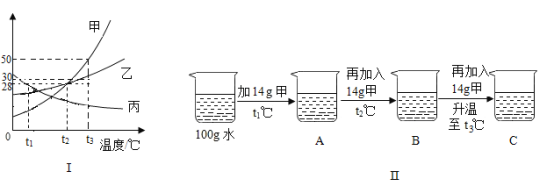
(1)t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是____。
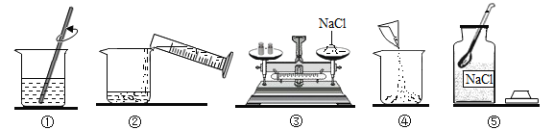
(2)某同学按图所示进行实验,得到相应温度下的A、B、C三种溶液,其中属于饱和溶液的是___(填字母)。
(3)t3℃时要把150g甲物质的饱和溶液中稀释成质量分数为20%的溶液,需加入水的质量为____克。
【答案】丙>乙>甲 B 100
【解析】
(1)由溶解度曲线可知,在t1℃时甲、乙、丙三种物质的溶解度由大到小的顺序是:丙>乙>甲;
②由图可知,t1℃时甲的溶解度大于14g,故A是不饱和溶液;t2℃时甲物质的溶解度是28g,即100g水中最多可以溶解28g甲物质,所以B溶液是饱和溶液;t3℃时甲物质的溶解度是50g,在C溶液中含有溶质的质量是42g,是不饱和溶液;故填B。
③t3℃时,甲物质的溶解度是50g, 故150g饱和溶液中溶质的质量分数为:![]() ×100%=33.3% ,设把150g甲物质的饱和溶液中稀释成质量分数为20%的溶液,需加入水的质量为x,150g×
×100%=33.3% ,设把150g甲物质的饱和溶液中稀释成质量分数为20%的溶液,需加入水的质量为x,150g×![]() ×100%=(150g+x)×20%,解得x=100g
×100%=(150g+x)×20%,解得x=100g

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】九年级课外活动小组的同学们在期末复习时,来到化学实验室亲自对“质量守恒定律”进行了再次探究,如图是他们根据这一学期学过的化学反应分别设计的实验,请你一起参与他们的探究活动,并回答相关问题

实验1:称量镁条,点燃,待反应结束后,再称量。
实验2:将盛有稀盐酸的小试管放入盛有锌粒的烧杯中称量,然后使稀盐酸与锌粒接触,充分反应后再称量实验3:将盛有氢氧化钠溶液的小试管放入盛有硫酸铜溶液的锥形瓶中称量,然后使氢氧化钠溶液与硫酸铜溶液混合,充分反应后再称量。
编号 | 实验1 | 实验2 | 实验3 |
反应前称重质量 | 9.6g | 212.6g | 118.4g |
反应后称重质量 | 16.0g | 212.4g | 118.4g |
(1)实验1观察到的现象是_______________;
(2)写出实验3反应的化学方程式________________;
(3)上述三个反应______________(填“符合”或“不符合”)质量守恒定律,实验___________正确反映了反应物与生成物的质量关系;
(4)由上述实验我们得到启示,探究_______________的反应验证质量守恒定律,实验必须在密闭的装置中进行;
(5)由质量守恒定律可知,化学反应前后,一定不变的是 _____________(填序号);
①物质种类 ②元素种类 ③原子种类 ④分子种类 ⑤分子数目 ⑥原子数目
【题目】某实验小组的同学为了测定实验室中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g.依次加热该混合物t1、t2、t3、t4时间后,分别冷却称量剩余固体质量,记录的有关数据如下表(样品中的杂质不参与化学反应):
加热时间 | t1 | t2 | t3 | t4 |
剩余固体质量/g | 4.24 | 4.16 | 4.08 | 4.08 |
试计算:
(1)完全反应后产生的氧气的总质量为_______。
(2)样品中氯酸钾的纯度是多少_______?