题目内容
下表为元素周期表的部分元素的相关信息,利用下表回答相关问题

(1)17号元素的名称是
(2)11号元素属于
(3)某元素R与硫酸根形成化合物的化学式为:RSO4,其相对分子质量为152,则R的元素符号为

(1)17号元素的名称是
氯
氯
,在化学反应中该原子比较容易得到
得到
(填“得到”或“失去”)电子变成离子,推测该元素最低负化合价为-1
-1
.(2)11号元素属于
金属
金属
元素(填“金属”或“非金属”),它在化学反应中形成的粒子与Ne
Ne
(写元素符号)原子具有相同的核外电子排布.(3)某元素R与硫酸根形成化合物的化学式为:RSO4,其相对分子质量为152,则R的元素符号为
Fe
Fe
.分析:(1)根据元素周期表可知17号元素的名称,17号元素为氯元素,其最外层电子数为7,已得到电子而达到8电子的稳定结构,其最低负化合价为-1,可以据此解答该题;
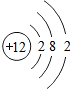
(2)根据元素周期表分析11号元素,为钠元素,为金属元素,其最外层电子数为1,易失去电子,而达到8电子的相对稳定结构,其结构与氖元素的原子具有相同的核外电子排布,可以据此解答该题;
(3)某元素R与硫酸根形成化合物的化学式为:RSO4,其相对分子质量为152,计算出R的相对原子质量,然后作出判断即可.
(2)根据元素周期表分析11号元素,为钠元素,为金属元素,其最外层电子数为1,易失去电子,而达到8电子的相对稳定结构,其结构与氖元素的原子具有相同的核外电子排布,可以据此解答该题;
(3)某元素R与硫酸根形成化合物的化学式为:RSO4,其相对分子质量为152,计算出R的相对原子质量,然后作出判断即可.
解答:解:(1)根据元素周期表可知17号元素的名称,17号元素为氯元素,其最外层电子数为7,已得到电子而达到8电子的稳定结构,其最低负化合价为-1;
(2)根据元素周期表分析11号元素,为钠元素,为金属元素,其最外层电子数为1,易失去电子,而达到8电子的相对稳定结构,其结构与氖元素的原子具有相同的核外电子排布,其中氖元素的元素符号为:Ne;
(3)设R的相对原子质量为x,则:
x+32+16×4=152
解得:x=56
故元素R为铁;
故答案为:(1)氯;得到;-1;
(2)金属;Ne;
(3)Fe.
(2)根据元素周期表分析11号元素,为钠元素,为金属元素,其最外层电子数为1,易失去电子,而达到8电子的相对稳定结构,其结构与氖元素的原子具有相同的核外电子排布,其中氖元素的元素符号为:Ne;
(3)设R的相对原子质量为x,则:
x+32+16×4=152
解得:x=56
故元素R为铁;
故答案为:(1)氯;得到;-1;
(2)金属;Ne;
(3)Fe.
点评:本题考查学生根据原子结构示意图分析总结元素周期律及对元素的性质与最外层电子数的关系的理解与掌握,并能在解题中灵活应用.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目











 a
a















 10Ne
10Ne



 18Ar
18Ar
 表示的是
表示的是

 表示的是
表示的是