题目内容
18.欲鉴别稀硫酸和澄清石灰水.请按要求举出合适的试剂实例(用化学式表示)①用一种金属单质鉴别Fe;
②用一种金属氧化物鉴别CuO;
③用一种非金属氧化物鉴别CO2;
④用一种盐鉴别Na2CO3;
⑤用一种碱鉴别Cu(OH)2.
分析 根据酸和碱的性质以及性质差异进行分析解答即可.
解答 解:①铁能与稀硫酸反应,与澄清的石灰水不反应,故可以用铁鉴别二者,故填:Fe;
②氧化铜能与稀硫酸反应,与澄清的石灰水不反应,故可以用氧化铜鉴别二者,故填:CuO;
③二氧化碳不能与稀硫酸反应,能与澄清石灰水反应使澄清的石灰水变浑浊,故可以使用二氧化碳鉴别二者,故填:CO2;
④碳酸钠能与稀硫酸反应产生二氧化碳气体,碳酸钠能与澄清石灰水反应产生白色碳酸钙沉淀,故可以使用碳酸钠鉴别二者,故填:Na2CO3;
⑤氢氧化铜能与稀硫酸反应产生蓝色溶液,氢氧化铜与澄清的石灰水不反应,故可以使用氢氧化铜鉴别二者,故填:Cu(OH)2.
点评 掌握常见的物质的性质差异以及物质间反应的实验现象是正确解答本题的关键.

练习册系列答案
相关题目
8.小林同学取四份50克水后,分别加入一定质量的硝酸钾固体配制成t℃的溶液,充分搅拌后,滤去未溶解的固体,将相关数据记录如表:
根据以上数据,
(1)试判断从第3步骤开始所配制的溶液是饱和溶液;
(2)计算t℃时硝酸钾饱和溶液的溶质质量分数.(结果精确到0.1%)
| 操作序号 | 1 | 2 | 3 | 4 |
| 加入硝酸钾的质量/克 | 40 | 50 | 60 | 70 |
| 溶液的质量/克 | 90 | 100 | 105 | 105 |
(1)试判断从第3步骤开始所配制的溶液是饱和溶液;
(2)计算t℃时硝酸钾饱和溶液的溶质质量分数.(结果精确到0.1%)
9.实验小组用如图的装置进行实验.
请你归纳实验目的:加热氯酸钾和二氧化锰的混合物制取氧气并测量收集氧气的体积.
| 实 验 步 骤 | 简 答 |
(1)称取3g氯酸钾与少量二氧化锰混合后放入装置①的试管中,点燃酒精灯. | 装入药品前要检查装置的气密性 ; 分别用中文名称和化学符号写出a试管中发生反应的表达式:氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑. |
(2)加热试管一段时间后,再用橡皮管连接a、b;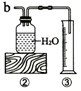 当装置②中水面不再下降,断开a、b,移去酒精灯. | 为什么“加热试管一段时间后,再用橡皮管连接a、b”?原因是:一开始排出的是试管中的空气; ③中使用量筒的作用是通过测量水的体积测量收集的氧气体积. |
13.有一包白色固体,可能含有CuCl2、CaCO3、NaOH、Ba(OH)2、BaCl2、Na2SO4中的几种.为确定其组成,取适量试样进行下列实验.请根据实验现象判断:
①取试样溶于水,搅拌、过滤,得到无色澄清溶液A和白色沉淀B;
②取上述无色澄清溶液A,通入适量的CO2,生成白色沉淀C;
③取上述白色沉淀B,加入过量的稀硝酸,沉淀全部消失.
综合上述实验现象,下列判断正确的是( )
①取试样溶于水,搅拌、过滤,得到无色澄清溶液A和白色沉淀B;
②取上述无色澄清溶液A,通入适量的CO2,生成白色沉淀C;
③取上述白色沉淀B,加入过量的稀硝酸,沉淀全部消失.
综合上述实验现象,下列判断正确的是( )
| A. | 由①得原白色固体中一定不含CuCl2,一定含量有CaCO3 | |
| B. | 由②③得原白色固体中一定含有Ba(OH)2,一定不含量有Na2SO4 | |
| C. | 由实验现象判断,白色固体中至少有3种固体 | |
| D. | 由实验现象判断,白色固体的组成可有5种情况 |
3.铜能制成铜片和拉成铜丝,是因为铜具有良好的( )
| A. | 导热性 | B. | 导电性 | C. | 延展性 | D. | 金属活动性 |
10.下列物质的名称、化学式、分类均正确的是( )
| A. | 硫酸钠 NaSO4 盐 | B. | 氧化钙CaO氧化物 | ||
| C. | 烧碱 KOH碱 | D. | 碳酸钠Na2CO3 酸 |
7.下列物质由分子构成的是( )
| A. | 氯化钠 | B. | 金属铜 | C. | 干冰 | D. | 金刚石 |
8.将一定量的铁粉放入硝酸铜和硝酸银的混合溶液中,充分反应后过滤,在滤纸上留下少量金属a,并得到滤液b.下列关于a或b的组成说法错误的是( )
| A. | 若向a中滴加稀盐酸有气泡生成,则a中一定含有Fe、Cu、Ag | |
| B. | 若向a中滴加稀盐酸无气泡生成,则b中一定含有Cu2+ | |
| C. | 若向b中滴加稀盐酸无明显变化,则b中一定不含Ag+ | |
| D. | 若向b中滴加稀盐酸产生白色沉淀,则a中一定不含Cu、Fe |
 学习化学时可用如图表示某些从属关系,下列选项正确的是( )
学习化学时可用如图表示某些从属关系,下列选项正确的是( )