题目内容
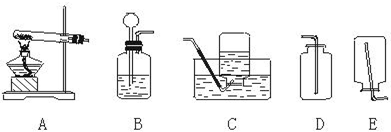
9.根据如图完成
(1)用固体与液体在常温下反应产生气体应选(填序号)A;用固体受热反应产生气体应选B;收集难溶性气体应选D;收集常温下密度比空气密度大且无毒的气体应选C.
(2)实验室用加热固体醋酸钠和碱石灰粉末的方法制备甲烷气体(密度比空气小),可选用B和E装置连接制取和收集甲烷.
(3)A中长颈漏斗伸到液面以下,是为了防止气体从长颈漏斗逸出;B的试管口略向下倾斜是为了水倒流回试管底部,造成试管炸裂;伸进C、E的导管均应接近集气瓶底部,是为了排净集气瓶内的空气.
分析 (1)根据反应物的状态和反应条件决定制取装置,气体的性质决定收集方法来分析;
(2)用无水醋酸钠固体和固体碱石灰加热制取甲烷气体,属固体和固体混合反应条件是加热,所以发生装置选择B装置;甲烷的密度比空气小.所以可用向下排空气法收集;
(3)根据实验操作中的注意事项分析.
解答 解:(1)固液常温下制取气体选择装置A,固体加热选择B装置来制取气体,难溶性气体可选用排水法来收集;常温下密度比空气密度大且无毒的气体应选向上排空气法来收集;故填:A;B;D;C;
(2)用无水醋酸钠固体和固体碱石灰加热制取甲烷气体,属固体和固体混合反应条件是加热,所以发生装置选择B装置;甲烷的密度比空气小.所以可用向下排空气法收集;故填:B;E;
(3)为了防止受热后产生的水倒流回试管,B中试管口略向下倾斜.A中长颈漏斗末端应伸到液面以下,可以防止产生的气体逸出.伸进C、E中的导管均应接近集气瓶底部,是为了将瓶中的空气排净.故填:气体从长颈漏斗逸出;水倒流回试管底部,造成试管炸裂;排净集气瓶内的空气.
点评 了解发生装置据反应物状态和反应条件进行选择,并明确实验室制取二氧化碳的药品、收集装置据气体的密度和溶解性进行选择等知识,并能灵活分析解答.

练习册系列答案
相关题目
20.实验中,人的五官起着非常重要的作用,下列五官的使用符合实验要求的是( )
| A. |  鼻子闻 | B. |  嘴巴吹 | C. |  耳朵听 | D. |  眼睛看 |
17.一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如表
关于此反应,下列认识正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 4 | 1 | 42 | 10 |
| 反应后质量(g) | 4 | 20 | 6 | 待测 |
| A. | 该变化的基本反应类型一定是化合反应 | |
| B. | 丁反应后的质量为13克 | |
| C. | 反应中甲可能是催化剂 | |
| D. | 乙与丙的物质的量之比是19:36 |
4.一定温度下,将200克A的溶液二等分.将其中一份恒温蒸发掉10克水,析出4克A固体;另一份恒温蒸发掉20克水,析出10克A固体.则该温度下,A的溶解度为( )
| A. | 40克/100克水 | B. | 60克/100克水 | C. | 46.7克/100克水 | D. | 无法确定 |
14. 草酸的化学式为H2C2O4,某实验小组对草酸受热分解及其产物进行探究:
草酸的化学式为H2C2O4,某实验小组对草酸受热分解及其产物进行探究:
【猜想与假设】猜想1:分解产物是 CO2、H2O
猜想2:分解产物是CO、H2O
猜想3:分解产物是CO2、CO
猜想4:分解产物是CO2、CO和H2O
根据质量守恒定律,以上猜想中,不可能的猜想是猜想3.
【查阅资料】(1)无水硫酸铜遇水由白色变成蓝色
(2)碱石灰(CaO和NaOH的混合物)是一种常用的干燥剂
(3)草酸晶体熔点较低,加热到182℃即可以熔化成液体
【实验设计】实验小组设计了如图的实验装置.
(注:①图中铁架台略去 ②装置中所用容器为底部弯曲的试管)
【实验过程】
【实验结论】猜想4是正确的,请写出草酸受热分解的化学方程式H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+CO↑+H2O↑.
 草酸的化学式为H2C2O4,某实验小组对草酸受热分解及其产物进行探究:
草酸的化学式为H2C2O4,某实验小组对草酸受热分解及其产物进行探究:【猜想与假设】猜想1:分解产物是 CO2、H2O
猜想2:分解产物是CO、H2O
猜想3:分解产物是CO2、CO
猜想4:分解产物是CO2、CO和H2O
根据质量守恒定律,以上猜想中,不可能的猜想是猜想3.
【查阅资料】(1)无水硫酸铜遇水由白色变成蓝色
(2)碱石灰(CaO和NaOH的混合物)是一种常用的干燥剂
(3)草酸晶体熔点较低,加热到182℃即可以熔化成液体
【实验设计】实验小组设计了如图的实验装置.
(注:①图中铁架台略去 ②装置中所用容器为底部弯曲的试管)
【实验过程】
| 实验操作 | 实验现象 | 实验结论 |
| 1.加热草酸晶体 | 无水硫酸铜变蓝色 | 说明有水(H2O)生成. |
| 澄清石灰水变浑浊 | 说明有二氧化碳(CO2)生成. | |
| 2.生成的气体通过碱石灰后,在干燥管的尖嘴处点燃,并在上方罩上内壁附着有澄清石灰水的小烧杯. | 气体燃烧,烧杯内壁的澄清石灰水变浑浊. | 说明有一氧化碳(CO);生成. |
1.小明同学看到妈妈把买来的排水口洗净剂(主要成分:过碳酸钠、柠檬酸)洒在厨房排水口网状盖的底部,倒上温水后迅速冒出气泡.为了解其反应过程,他与学习小组的同学进行了如下探究.

【活动探究一】教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究:
【提出问题1】无色溶液X中的溶质有哪些物质?
【猜想与假设】根据以上实验现象,无色溶液X中一定存在的溶质是H2O2.
根据质量守恒定律,同学们对溶液X中还可能存在其它溶质,作出如下猜想:
①Na2CO3;②NaHCO3;③Na2CO3和 NaHCO3的混合物.
【查阅资料】
【实验探究】为了确定溶液X还可能存在的其它溶质,设计如下方案,请你一起完成.
【反思】实验步骤①中,氯化钙溶液过量的目的是除尽碳酸钠溶液,避免对碳酸氢钠溶液检验的干扰.
【活动探究二】
提出问题2:如何测量Na2CO3和NaHCO3的固体混合物中各成分的质量?
(1)为测量混合物中各成分的质量,小明设计了图1装置.通过称量B装置的质量变化来确定样品中各成分的质量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误.但多次发现,测定结果有偏差.造成偏差的原因有:①成的二氧化碳气体没有全部被氢氧化钠浓溶液吸收;②氢氧化钠浓溶液还吸收到了空气中的二氧化碳气体.

(2)在老师的指导下小明重新设计了图2的实验装置进行实验.小明取9.5g固体样品进行实验,实验完毕后测得B装置增重4.4g,则样品中各成分的质量分别为多少?(写出计算过程,计算结果保留一位小数.)
(可能用到的相对分子质量:Na2CO3:106,NaHCO3:84,CO2:44)

【活动探究一】教师提供了一瓶过碳酸钠(Na2CO4),小组同学进行了如下实验探究:
【提出问题1】无色溶液X中的溶质有哪些物质?
【猜想与假设】根据以上实验现象,无色溶液X中一定存在的溶质是H2O2.
根据质量守恒定律,同学们对溶液X中还可能存在其它溶质,作出如下猜想:
①Na2CO3;②NaHCO3;③Na2CO3和 NaHCO3的混合物.
【查阅资料】
| NaHCO3溶液 | Na2CO3溶液 | |
| 加入稀盐酸 | 现象Ⅰ | 产生气泡 |
| 加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
| 加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
| 加热溶液至沸腾, 将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
| 步骤 | 现象 | 结论与方程式 |
| ①取少量溶于水,加入过量CaCl2溶液. | 产生白色沉淀 | 该反应方程式: CaCl2+Na2CO3═CaCO3↓+2NaCl. |
| ②将上述反应后混合液过滤,取滤液 稀盐酸. | 有气泡冒出 | 证明猜想③成立. |
【活动探究二】
提出问题2:如何测量Na2CO3和NaHCO3的固体混合物中各成分的质量?
(1)为测量混合物中各成分的质量,小明设计了图1装置.通过称量B装置的质量变化来确定样品中各成分的质量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误.但多次发现,测定结果有偏差.造成偏差的原因有:①成的二氧化碳气体没有全部被氢氧化钠浓溶液吸收;②氢氧化钠浓溶液还吸收到了空气中的二氧化碳气体.

(2)在老师的指导下小明重新设计了图2的实验装置进行实验.小明取9.5g固体样品进行实验,实验完毕后测得B装置增重4.4g,则样品中各成分的质量分别为多少?(写出计算过程,计算结果保留一位小数.)
(可能用到的相对分子质量:Na2CO3:106,NaHCO3:84,CO2:44)
19.下列物质中属于氧化物的是( )
| A. | H2SO4 | B. | KOH | C. | CO | D. | KClO3 |
 如图所示A-F是初中化学常见的物质,图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,D是最轻的气体,B和C含有相同的组成元素.
如图所示A-F是初中化学常见的物质,图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,D是最轻的气体,B和C含有相同的组成元素.