题目内容
1. 如图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的个数是1.
如图是甲、乙、丙三种物质的溶解度曲线.下列说法正确的个数是1.(1)将甲、乙、丙的饱和溶液分别从t1℃升温到t2℃,溶质的质量分数都不变;
(2)t2℃时,向100g 20%甲的饱和溶液中加80g水,充分搅拌,溶液的一定浓度为10%;
(3)t3℃时,等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是甲;
(4)升高丙溶液的温度一定有晶体析出;
(5)t3℃时甲、乙、冰三种物质的饱和溶液降温到t2℃时,所得的溶液中溶质的质量分数的大小关系为乙>甲=丙
(6)将t2℃时甲、乙、丙三种物质的饱和溶液降温至t3℃时所得的溶液中溶质的质量分数的大小关系为乙>甲=丙
(7)将t3℃时的甲、乙饱和溶液降温至t2℃时析出晶体的质量关系一定是甲>乙.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)丙物质的溶解度,随温度的升高而减小,所以将甲、乙、丙的饱和溶液分别从t1℃升温到t2℃,甲、乙溶质的质量分数不变,丙的质量分数减小,故错误;
(2)t2℃时,向100g20%甲的饱和溶液中加80g水,充分搅拌,溶液的一定浓度为:$\frac{100g×20%}{100g+80g}$×100%=11.1%,故错误;
(3)t3℃时,甲物质的溶解度最大,丙物质的溶解度最小,所以等质量的甲、乙、丙分别制成饱和溶液,需水的质量最多的是丙,故错误;
(4)升高丙溶液的温度,溶液的状态不能确定,所以不一定有晶体析出,胡C错误;
(5)甲、乙物质的溶解度随温度的升高而增大,乙物质的溶解度随温度的升高而减小,t3℃时,甲、乙、丙三种物质的饱和溶液降温到t2℃时,乙物质的溶解度最大,甲次之,丙物质应该是t3℃时的溶解度,所以所得的溶液中溶质的质量分数的大小关系为乙>甲>丙,故错误;
(6)甲、乙物质的溶解度随温度的升高而增大,乙物质的溶解度随温度的升高而减小,所以将t2℃时甲、乙、丙三种物质的饱和溶液升温至t3℃时,所得的溶液中溶质的质量分数的大小关系为乙>甲>丙,故C错误;
(7)在t3℃---t2℃,甲物质溶解度变化较大,乙物质变化较小,所以将t3℃时的甲、乙饱和溶液降温至t2℃时析出晶体的质量关系一定是甲>乙,故正确.
所以说法正确的个数是1.
故答案为:1.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

 名校课堂系列答案
名校课堂系列答案| A. | 石油的分馏 | B. | 白酒挥发 | C. | 饭菜变馊 | D. | 水结冰 |
| A. | 黑芥子甙是由五种元素组成的有机化合物 | |
| B. | 黑芥子甙含有39个原子 | |
| C. | 黑芥子甙中C,H,N,O,S的原子个数比为10:17:9:1:2 | |
| D. | 黑芥子甙的相对分子质量为359g |
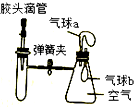 如图所示,装置气密性良好,弹簧夹处于关闭状态.试管中装有少量二氧化锰,挤压胶头滴管加入双氧水,打开弹簧夹,能观察到的现象是( )
如图所示,装置气密性良好,弹簧夹处于关闭状态.试管中装有少量二氧化锰,挤压胶头滴管加入双氧水,打开弹簧夹,能观察到的现象是( )| A. | 气球a鼓起,气球b鼓起 | B. | 气球a鼓起,气球b变瘪 | ||
| C. | 气球a变瘪,气球b鼓起 | D. | 气球a变瘪,气球b 变瘪 |

 取一个小玻璃杯,放入洗净的碎鸡蛋壳,然后加入一些醋精(主要成分是醋酸),立即用蘸有澄清石灰水的玻璃片盖住.仔细观察有什么现象发生.试根据实验现象推测鸡蛋壳里可能含有什么物质.
取一个小玻璃杯,放入洗净的碎鸡蛋壳,然后加入一些醋精(主要成分是醋酸),立即用蘸有澄清石灰水的玻璃片盖住.仔细观察有什么现象发生.试根据实验现象推测鸡蛋壳里可能含有什么物质.