题目内容
4.在氢氧化钠溶液中加入x溶液并插入温度计,逐滴加入硫酸溶液,观察到红色褪去,温度计示数上升.证明碱与酸能发生反应,且放出热量.(1)加入的X溶液应该是无色酚酞溶液;
(2)请写出该反应的化学反应方程式2NaOH+H2SO4═Na2SO4+2H2O;
(3)甲同学提出滴入的硫酸不能用浓硫酸,他的理由是浓硫酸溶于水放出大量的热
(4)乙同学提出红色褪去不能说明酸和碱恰好反应完全,为了证明硫酸是否过量,可以取上层清液再加入②(填序号),若有现象,说明硫酸过量.
①铜 ②镁 ③BaCl2溶液 ④KOH溶液.
分析 (1)根据氢氧化钠与稀硫酸反应生成硫酸钠和水,但无明显变化,可借助酸碱指示剂来判断反应是否进行,进行分析解答.
(2)氢氧化钠与稀硫酸反应生成硫酸钠和水,写出反应的化学方程式即可.
(3)根据浓硫酸溶于水放出大量的热,进行分析解答.
(4)根据酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应),进行分析解答.
解答 解:(1)在氢氧化钠溶液中加入x溶液并插入温度计,逐滴加入硫酸溶液,观察到红色褪去,无色酚酞溶液遇碱性溶液变红色,则加入的X溶液应该是无色酚酞溶液.
(2)氢氧化钠与稀硫酸反应生成硫酸钠和水,反应的化学方程式为:2NaOH+H2SO4═Na2SO4+2H2O.
(3)浓硫酸溶于水放出大量的热,不能确定产生的热量是浓硫酸溶于水形成的,还是中和反应产生的.
(4)铜的金属活动性比氢弱,不能与稀硫酸反应,不能用于证明硫酸是否过量;镁的金属活动性比氢强,能与稀硫酸反应生成硫酸镁和氢气,会观察到有气泡产生;硫酸钠、硫酸均能与BaCl2溶液反应生成硫酸钡白色沉淀,不能确定是否含硫酸;硫酸能与KOH溶液反应生成硫酸钾和水,但无明显变化,不能用于证明硫酸是否过量.
故答案为:(1)无色酚酞;(2)2NaOH+H2SO4═Na2SO4+2H2O;(3)浓硫酸溶于水放出大量的热;(4)②.
点评 本题难度不大,掌握中和反应应用、酸的化学性质并能灵活运用是正确解答本题的关键.

练习册系列答案
相关题目
14.铜能够制成铜片或拉成铜丝,是因为铜具有良好的( )
| A. | 延展性 | B. | 导热性 | C. | 导电性 | D. | 金属活动性 |
15.下列各组气体混合,气体点燃后可能发生爆炸的是( )
| A. | H2,和CO | B. | H2和N2 | C. | CH4 和CO2 | D. | CO和 空气 |
8.下列实验能达目的是( )
| A. |  测溶液的pH | B. |  稀释浓硫酸 | C. |  加热液体 | D. |  取用液体试剂 |
9.下列几种粒子的结构示意图中表示阴离子的是( )
| A. |  | B. |  | C. |  | D. |  |
 如图中的A、B、C、D、E是初中化学常见的纯净物,且分别是由H、C、O、Cl、Na、Ca中的两种或两种以上元素组成.其中气体A为氧化物,且两种元素质量之比为3:8;固体B由三种元素组成,取少量B放入试管中,加入水振荡,溶液呈浑浊状.将B久置于A中能生成物质C,将C放入D溶液又能生成A.且图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物或生成物已略去.
如图中的A、B、C、D、E是初中化学常见的纯净物,且分别是由H、C、O、Cl、Na、Ca中的两种或两种以上元素组成.其中气体A为氧化物,且两种元素质量之比为3:8;固体B由三种元素组成,取少量B放入试管中,加入水振荡,溶液呈浑浊状.将B久置于A中能生成物质C,将C放入D溶液又能生成A.且图中“-”表示两端的物质间能发生化学反应,“→”表示物质间存在转化关系,部分反应物或生成物已略去.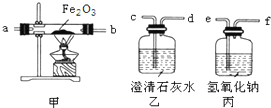 4月17日,重庆市渝中区石板坡的一幢民房发生火灾后,某中学化学兴趣小组想探究火灾现场附近的空气中是否含有CO气体.设计实验方案如下:
4月17日,重庆市渝中区石板坡的一幢民房发生火灾后,某中学化学兴趣小组想探究火灾现场附近的空气中是否含有CO气体.设计实验方案如下: 如图是A、B、C三种物质的溶解度曲线.
如图是A、B、C三种物质的溶解度曲线.