题目内容
16.某化工厂排出澄清的废水,其中可能含有的离子是Ba2+、Fe3+、Fe2+、Ag+、Cu2+、SO42-、Cl-、NO3-.[已知:白色的Fe(OH)2沉淀在空气中会迅速转化为红褐色的Fe(OH)3.]
①取少量废水,加入过量稀盐酸,产生白色沉淀,过滤,将滤液分成两份,一份加入稀硫酸,产生白色沉淀;另一份加入过量NaOH溶液,产生蓝色沉淀.
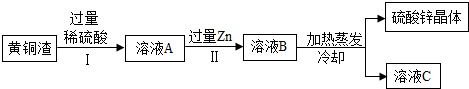
②某化学兴趣小组设计了一个处理该废水的实验方案,部分流程如图:
下列说法正确的是 (填字母).( )
| A. | 在①中,向一份滤液中加入过量NaOH溶液,其中与OH-反应的离子是H+、Cu2+ | |
| B. | 在②中,固体A中一定含有Ag和Cu,可能含有Fe | |
| C. | 在②中,溶液B的溶质有Ba(NO3)2、Fe(NO3)3 | |
| D. | 废水中含有Ba2+、Ag+、Cu2+、Fe2+、NO3- |
分析 根据酸、碱、盐之间的反应及物质的性质进行分析解答.
解答 解:①废液中可能含有的金属离子有Ag+,加入过量稀盐酸后,银离子将与氯离子结合生成氯化银白色沉淀,其化学式为AgCl;滤液中含有Ba2+,加入硫酸后,将与硫酸根离子结合而生成硫酸钡沉淀,其化学式为BaSO4;而另一份加入过量NaOH溶液的滤液,其中的Cu2+会与氢氧根离子结合生成氢氧化铜蓝色沉淀,除此之外,水中的氢离子也会与氢氧根离子结合成水;②由题中的框图可知:已知红褐色固体是氢氧化铁,可知X是金属铁,铁把银、铜置换出来,故固体A为Ag、Cu、Fe;又由于加入过量的铁和出现的白色沉淀,所以B溶液中一定有Fe(NO3)2和Ba(NO3)2;废液中不含有Fe2+,该流程常被用于重金属离子的除杂,所以可把废水中原有的金属离子除去;
A、在①中,向一份滤液中加入过量NaOH溶液,其中与OH-反应的离子是H+、Cu2+,正确;
B、在②中,固体A中一定含有Ag和Cu、Fe,错误;
C、在②中,溶液B的溶质有Ba(NO3)2、Fe(NO3)2,错误;
D、废水中不含有Ba2+,错误;
故选A.
点评 本题只有熟练掌握酸碱盐的化学性质才能快速准确的做出这类题的正确答案,本题综合性强,有利于培养学生分析实验解决实验的能力

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.下列实验设计不能达到实验目的是( )
| A. | 加入过量稀盐酸除去氢氧化钠溶液中混有的少量碳酸钠 | |
| B. | 用在空气中灼烧的方法去掉氧化铜中的铜 | |
| C. | 加入熟石灰,然后用研磨的方法鉴别氯化钾与氯化铵固体 | |
| D. | 用水鉴别碳酸钙和氢氧化钠两种粉末状固体 |
4.下列生活中的物质,属于纯净物的是( )
| A. | 干冰 | B. | 铁钉 | C. | 加碘食盐 | D. | 铅笔芯 |
11.网络神曲“化学是你,化学是我”揭示了化学与生活的密切关系,下列有关说法中正确的是( )
| A. | 燃烧是人类最早利用的化学反应之一,可燃物温度达到着火点即可燃烧 | |
| B. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 | |
| C. | 碳酸钠俗名纯碱,可用于清洗厨房用具的油污 | |
| D. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的消毒杀菌 |
1.下列变化中,属于物理变化的是( )
| A. | 煤气燃烧 | B. | 牛奶变酸 | C. | 铁锅生锈 | D. | 蔬菜洗涤 |
8. 全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等,关于汞元素的相关信息正确的是( )
全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等,关于汞元素的相关信息正确的是( )
 全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等,关于汞元素的相关信息正确的是( )
全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等,关于汞元素的相关信息正确的是( )| A. | 汞原子的中子数是80 | B. | 汞原子的质量为200.8g | ||
| C. | 汞的化学式为Hg | D. | 汞为非金属元素 |
5.翡翠的主要成份是硬玉[化学式为NaAl(Si2O6)],其中硅元素的化合价是( )
| A. | +2 | B. | +4 | C. | -2 | D. | -4 |
6.下列有关氧气的性质或用途正确的是( )
| A. | 标准状况下密度比空气小 | B. | 易溶于水 | ||
| C. | 可以供给呼吸 | D. | 可以灭火 |