题目内容
15.由某物质X和Na2SO4组成的固体混合物放入足量水中,充分搅拌,过滤后得到白色沉淀11.65g,经试验该白色沉淀不溶于稀硝酸.然后向滤液中加入146g5%的盐酸溶液恰好能使滤液呈中性.由以上条件能否求出混合物中Na2SO4的质量分数?若能,请求出;若不能,你认为还需要补充什么条件?分析 根据某物质X和Na2SO4组成的固体混合物放入足量水中,充分搅拌,过滤后得到白色沉淀11.65g,经试验该白色沉淀不溶于稀硝酸,所以该沉淀是硫酸钡沉淀,向滤液中加入146g5%的盐酸溶液恰好能使滤液呈中性,所以滤液中含有氢氧根离子,所以X是氢氧化钡,然后结合题中的数据进行解答.
解答 解:某物质X和Na2SO4组成的固体混合物放入足量水中,充分搅拌,过滤后得到白色沉淀11.65g,经试验该白色沉淀不溶于稀硝酸,所以该沉淀是硫酸钡沉淀,向滤液中加入146g5%的盐酸溶液恰好能使滤液呈中性,所以滤液中含有氢氧根离子,所以X是氢氧化钡,
由题意可推断出X为Ba(OH)2,设参加反应的硫酸钠中为y,与硫酸钡反应的氢氧化钡质量为x,与盐酸反应的氢氧化钡质量为z,
BaSO4~Ba(OH)2~Na2SO4 2HCl~Ba(OH)2
233 171 142 73 171
11.65g x y 146g×5% z
$\frac{233}{11.65g}$=$\frac{171}{x}$=$\frac{142}{y}$ $\frac{73}{146g×5%}$=$\frac{171}{z}$
x=8.55g
z=17.1g
y=7.1g
∵17.1g>8.55g,
∴Ba(OH)2过量
所以:Na2SO4%=$\frac{7.1g}{7.1g+17.1g}$×100%=29.3%.
故答案为:29.3%.
点评 本题考查了酸与碱的中和反应间的计算问题,完成此题,要认真分析题干给出的条件,明确题中所发生的反应,根据给出的数据进行计算.本题的易错点就是只计算与硫酸钠反应的氢氧化钡的质量,而忽视了剩余的与硫酸酸反应的氢氧化钡的质量.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 用水灭火,是因为水能降低可燃物的着火点 | |
| B. | 铝抗腐蚀性比铁强,是因为铝不及铁活泼 | |
| C. | 使用石墨做铅笔芯,是因为石墨化学性质稳定 | |
| D. | 食品防腐远离甲醛,是因为甲醛能使人体蛋白质变性 |
 如图为某固体饱和溶液的浓度随温度变化的曲线.该固体从溶液中析出时不带结晶水.M、N两点分别表示该固体形成的两份溶液在不同温度时的浓度.当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断错误的是( )
如图为某固体饱和溶液的浓度随温度变化的曲线.该固体从溶液中析出时不带结晶水.M、N两点分别表示该固体形成的两份溶液在不同温度时的浓度.当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断错误的是( )| A. | 保持温度不变,蒸发溶剂时,先是M点不动,N点向左平移至曲线;继续蒸发溶剂,M、N点都不动 | |
| B. | 都升温10℃后,M、N点均向右平移 | |
| C. | 都降温10℃后,M点沿曲线向左下移,N点向左平移 | |
| D. | 保持温度不变,加水稀释时,M、N点均向下移动 |
| A. | 蜡烛燃烧化为气体,固体消失,该反应不符合质量守恒定律 | |
| B. | 镁在空气中完全燃烧后固体质量增加,这不符合质量守恒定律 | |
| C. | 质量守恒定律只适用于有气体或固体生成的化学反应 | |
| D. | 一切化学反应都遵从质量守恒定律 |
| A. | 分子、原子是不带电的粒子,但不带电的粒子不一定是分子、原子 | |
| B. | 元素的种类决定于质子数,因此,质子数相等的粒子属于同种元素 | |
| C. | 单质中只含有一种元素,因此,只含一种元素的物质一定是单质 | |
| D. | 根据质量守恒定律,任何化学反应中,反应物的质量总和一定等于生成物的质量总和 |
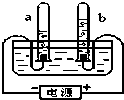 如图是电解水的装置.试回答下列问题:通电后电极上产生气泡,并汇集到试管上端.正极产生的气体是氧气,若负极产生气体的体积为10ml,则正极产生气体的体积为5ml;该实验说明水是由氢元素和氧元素 组成,电解
如图是电解水的装置.试回答下列问题:通电后电极上产生气泡,并汇集到试管上端.正极产生的气体是氧气,若负极产生气体的体积为10ml,则正极产生气体的体积为5ml;该实验说明水是由氢元素和氧元素 组成,电解