题目内容
有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求:
(1)D点的纵坐标.
(2)原混合液中盐酸溶质的质量分数.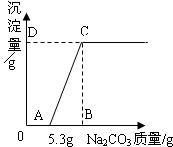
(1)D点的纵坐标.
(2)原混合液中盐酸溶质的质量分数.

(1)设生成碳酸钙的质量为x.
混合液中CaCl2的质量=100 g×5.55%=5.55 g
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
5.55 g x
=
x=5 g,即D点的纵坐标为5.
(2)设混合液中盐酸溶质的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
5.3g y
=
y=3.65 g
w(HCl)%=
×100%=3.65%
答:原混合液中盐酸溶质的质量分数为3.65%.
故答案为:(1)5(2)3.65%.
混合液中CaCl2的质量=100 g×5.55%=5.55 g
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
5.55 g x
| 111 |
| 5.55g |
| 100 |
| x |
x=5 g,即D点的纵坐标为5.
(2)设混合液中盐酸溶质的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
5.3g y
| 106 |
| 5.3g |
| 73 |
| y |
y=3.65 g
w(HCl)%=
| 3.65g |
| 100g |
答:原混合液中盐酸溶质的质量分数为3.65%.
故答案为:(1)5(2)3.65%.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目

 有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求:
有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求: 有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求:
有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求: