题目内容
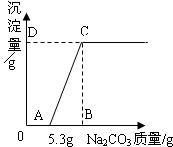
 有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求:
有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求:(1)D点的纵坐标.
(2)原混合液中盐酸溶质的质量分数.
分析:根据图示可知当碳酸钠的质量为5.3克时,没有沉淀生成,故此过程碳酸钠和盐酸反应,根据碳酸钠的质量可以计算出盐酸的质量,进而求出盐酸的质量分数;根据混合液的总质量和其中氯化钙的质量分数可以求得氯化钙的质量,具化学方程式可以求出产生沉淀的总质量.
解答:解:(1)设生成碳酸钙的质量为x.
混合液中CaCl2的质量=100 g×5.55%=5.55 g
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
5.55 g x
=
x=5 g,即D点的纵坐标为5.
(2)设混合液中盐酸溶质的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
5.3g y
=
y=3.65 g
w(HCl)%=
×100%=3.65%
答:原混合液中盐酸溶质的质量分数为3.65%.
故答案为:(1)5(2)3.65%.
混合液中CaCl2的质量=100 g×5.55%=5.55 g
Na2CO3+CaCl2═CaCO3↓+2NaCl
111 100
5.55 g x
| 111 |
| 5.55g |
| 100 |
| x |
x=5 g,即D点的纵坐标为5.
(2)设混合液中盐酸溶质的质量为y.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
5.3g y
| 106 |
| 5.3g |
| 73 |
| y |
y=3.65 g
w(HCl)%=
| 3.65g |
| 100g |
答:原混合液中盐酸溶质的质量分数为3.65%.
故答案为:(1)5(2)3.65%.
点评:本题主要考查学生运用化学方程式和溶质的质量分数公式进行计算的能力,解答本题的关键是要分析图表的数据对应的反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求:
有HCl和CaCl2混合液100g,向混合液中加入Na2CO3溶液,生成的沉淀(反应的化学方程式为CaCl2+Na2CO3═CaCO3↓+2NaCl)与加入Na2CO3质量的关系如图所示.若CaCl2在混合液中的质量分数为5.55%,求: