题目内容
实验小组在研究酸的化学性质时,做了下列所示5个实验.

(1)实验后,某试管中溶液呈浅绿色,该试管中发生反应的化学方程式为 .
(2)实验后,向某试管中滴加无色酚酞,溶液变红,再向此试管中加稀盐酸,只观察到溶液由红色变为无色.据此推断,该试管中最初发生的反应的化学方程式可能为 (写出一个即可).
(3)将(2)反应后的溶液,与上述五支试管中某试管反应后的溶液混合,看到先产生气体,后出现沉淀.则混合前两试管溶液中,溶质分别为 、 .混合后溶液中溶质可能为 (写出一种即可).
(4)科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.如图甲是实验时制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置.

①图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填字母编号);
②通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是 ;
③用乙装置完成“制取并验证CO2”的实验,消耗了0.73克10%的盐酸.请计算实验过程中产生CO2的质量是多少克? .

(1)实验后,某试管中溶液呈浅绿色,该试管中发生反应的化学方程式为
(2)实验后,向某试管中滴加无色酚酞,溶液变红,再向此试管中加稀盐酸,只观察到溶液由红色变为无色.据此推断,该试管中最初发生的反应的化学方程式可能为
(3)将(2)反应后的溶液,与上述五支试管中某试管反应后的溶液混合,看到先产生气体,后出现沉淀.则混合前两试管溶液中,溶质分别为
(4)科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径.如图甲是实验时制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置.

①图乙中微型塑料滴管在实验中的作用与图甲中的
②通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是
③用乙装置完成“制取并验证CO2”的实验,消耗了0.73克10%的盐酸.请计算实验过程中产生CO2的质量是多少克?
考点:酸的化学性质,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式,根据化学反应方程式的计算
专题:常见的酸 酸的通性
分析:(1)铁与盐酸反应生成的氯化亚铁溶液是浅绿色的,据此分析解答;
(2)向某试管中滴加无色酚酞,溶液变红,说明溶液显碱性,据此分析判断;
(3)将(2)反应后的溶液,与上述五支试管中某试管反应后的溶液混合,看到先产生气体,后出现沉淀;盐酸与碳酸盐反应生成气体,五支试管中可能形成的沉淀是碳酸钙;从而说明(2)反应后的溶液中含有盐酸、氯化钙,与之混合的溶液中含有碳酸根离子,碳酸盐过量,碳酸钙不溶于水,碳酸钠易溶于水,则说明是碳酸钠溶液与盐酸反应后的试管与实验(2)反应后的溶液混合,且碳酸钠过量,则该试管中的溶质是氯化钠、碳酸钠;
混合时因为先出现气体,后出现沉淀,说明溶液中盐酸反应完毕,故溶质中不会再有盐酸;混合后溶液中氯化钙与碳酸钠若恰好反应,则溶质只有氯化钠,若碳酸钠过量,则溶质是碳酸钠、氯化钠,若氯化钙过量,则溶质是氯化钙、氯化钠.
(4)①根据图乙中微型塑料滴管在实验中的作用与图甲中的分液漏斗仪器相同进行解答;
②根据采用“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,方便操作进行解答;
③根据化学方程式中使用的氯化氢质量可求得生成CO2的质量.
(2)向某试管中滴加无色酚酞,溶液变红,说明溶液显碱性,据此分析判断;
(3)将(2)反应后的溶液,与上述五支试管中某试管反应后的溶液混合,看到先产生气体,后出现沉淀;盐酸与碳酸盐反应生成气体,五支试管中可能形成的沉淀是碳酸钙;从而说明(2)反应后的溶液中含有盐酸、氯化钙,与之混合的溶液中含有碳酸根离子,碳酸盐过量,碳酸钙不溶于水,碳酸钠易溶于水,则说明是碳酸钠溶液与盐酸反应后的试管与实验(2)反应后的溶液混合,且碳酸钠过量,则该试管中的溶质是氯化钠、碳酸钠;
混合时因为先出现气体,后出现沉淀,说明溶液中盐酸反应完毕,故溶质中不会再有盐酸;混合后溶液中氯化钙与碳酸钠若恰好反应,则溶质只有氯化钠,若碳酸钠过量,则溶质是碳酸钠、氯化钠,若氯化钙过量,则溶质是氯化钙、氯化钠.
(4)①根据图乙中微型塑料滴管在实验中的作用与图甲中的分液漏斗仪器相同进行解答;
②根据采用“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,方便操作进行解答;
③根据化学方程式中使用的氯化氢质量可求得生成CO2的质量.
解答:解:(1)铁与盐酸反应生成的氯化亚铁溶液是浅绿色的,因此实验后,某试管中溶液呈浅绿色,说明该试管中发生反应的化学反应是铁和盐酸反应生成氯化亚铁和氢气;
(2)向某试管中滴加无色酚酞,溶液变红,说明溶液显碱性,且该碱性物质过量,图示实验中碳酸钠、氢氧化钠、氢氧化钙溶液均显碱性,均有可能;再向此试管中加稀盐酸,只观察到溶液由红色变为无色,说明溶液中一定不是碳酸钠,因为碳酸钠与稀盐酸反应还会生成气体,故可能是氢氧化钠和盐酸反应生成氯化钠和水,氢氧化钙和盐酸反应生成氯化钙和水,方程式分别是:NaOH+HCl=NaCl+H2O,2HCl+Ca(OH)2═CaCl2+2H2O;
(3)将(2)反应后的溶液,与上述五支试管中某试管反应后的溶液混合,看到先产生气体,后出现沉淀;盐酸与碳酸盐反应生成气体,五支试管中可能形成的沉淀是碳酸钙;从而说明(2)反应后的溶液中含有盐酸、氯化钙,与之混合的溶液中含有碳酸根离子,碳酸盐过量,碳酸钙不溶于水,碳酸钠易溶于水,则说明是碳酸钠溶液与盐酸反应后的试管与实验(2)反应后的溶液混合,且碳酸钠过量,则该试管中的溶质是氯化钠、碳酸钠;
混合时因为先出现气体,后出现沉淀,说明溶液中盐酸反应完毕,故溶质中不会再有盐酸;混合后溶液中氯化钙与碳酸钠若恰好反应,则溶质只有氯化钠,若碳酸钠过量,则溶质是碳酸钠、氯化钠,若氯化钙过量,则溶质是氯化钙、氯化钠;
(4)①图乙中微型塑料滴管在实验中的作用与图甲中的分液漏斗仪器相同,
故填:A;
②采用“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,方便操作,
故填:药品用量少,产生的废弃物也少,方便操作;
③设生成二氧化碳的质量为x
CaC03+2HCl═CaCl2+H20+C02↑
73 44
0.73g×10% x
=
x=0.044g
答:实验过程中产生CO2的质量是0.044g.
故答案为:(1)2HCl+Fe=FeCl2 +H2↑
(2)NaOH+HCl=NaCl+H2O或2HCl+Ca(OH)2 =CaCl2+2H2O
(3)CaCl2 HCl;Na2CO3 NaCl;Na2CO3、NaCl或(CaCl2、Na Cl)或(NaCl)
(4)A;药品用量少,产生的废弃物也少,操作方便(以上每空各1分)
解:设实验过程中产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑ (1分)
73 44
0.73克×10% x
73:44=0.73克×10%:x (1分)
解得x=0.044克(1分)
答:实验过程中产生CO2的质量为0.044克.
(2)向某试管中滴加无色酚酞,溶液变红,说明溶液显碱性,且该碱性物质过量,图示实验中碳酸钠、氢氧化钠、氢氧化钙溶液均显碱性,均有可能;再向此试管中加稀盐酸,只观察到溶液由红色变为无色,说明溶液中一定不是碳酸钠,因为碳酸钠与稀盐酸反应还会生成气体,故可能是氢氧化钠和盐酸反应生成氯化钠和水,氢氧化钙和盐酸反应生成氯化钙和水,方程式分别是:NaOH+HCl=NaCl+H2O,2HCl+Ca(OH)2═CaCl2+2H2O;
(3)将(2)反应后的溶液,与上述五支试管中某试管反应后的溶液混合,看到先产生气体,后出现沉淀;盐酸与碳酸盐反应生成气体,五支试管中可能形成的沉淀是碳酸钙;从而说明(2)反应后的溶液中含有盐酸、氯化钙,与之混合的溶液中含有碳酸根离子,碳酸盐过量,碳酸钙不溶于水,碳酸钠易溶于水,则说明是碳酸钠溶液与盐酸反应后的试管与实验(2)反应后的溶液混合,且碳酸钠过量,则该试管中的溶质是氯化钠、碳酸钠;
混合时因为先出现气体,后出现沉淀,说明溶液中盐酸反应完毕,故溶质中不会再有盐酸;混合后溶液中氯化钙与碳酸钠若恰好反应,则溶质只有氯化钠,若碳酸钠过量,则溶质是碳酸钠、氯化钠,若氯化钙过量,则溶质是氯化钙、氯化钠;
(4)①图乙中微型塑料滴管在实验中的作用与图甲中的分液漏斗仪器相同,
故填:A;
②采用“微型”实验装置具有的优点是药品用量少,产生的废弃物也少,方便操作,
故填:药品用量少,产生的废弃物也少,方便操作;
③设生成二氧化碳的质量为x
CaC03+2HCl═CaCl2+H20+C02↑
73 44
0.73g×10% x
| 73 |
| 0.73g×10% |
| 44 |
| x |
x=0.044g
答:实验过程中产生CO2的质量是0.044g.
故答案为:(1)2HCl+Fe=FeCl2 +H2↑
(2)NaOH+HCl=NaCl+H2O或2HCl+Ca(OH)2 =CaCl2+2H2O
(3)CaCl2 HCl;Na2CO3 NaCl;Na2CO3、NaCl或(CaCl2、Na Cl)或(NaCl)
(4)A;药品用量少,产生的废弃物也少,操作方便(以上每空各1分)
解:设实验过程中产生CO2的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑ (1分)
73 44
0.73克×10% x
73:44=0.73克×10%:x (1分)
解得x=0.044克(1分)
答:实验过程中产生CO2的质量为0.044克.
点评:此题综合考查了酸、碱、盐的相关化学性质和二氧化碳的性质,综合性强,要求学生熟练掌握基础知识才能很好的解答本题.

练习册系列答案
相关题目
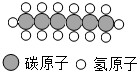 苹果公司使用正己烷清洗液晶显示屏造成了多名员工的身体受到不同程度的毒害,正己烷的分子结构如图所示,下列关于正已烷的叙述错误的是( )
苹果公司使用正己烷清洗液晶显示屏造成了多名员工的身体受到不同程度的毒害,正己烷的分子结构如图所示,下列关于正已烷的叙述错误的是( )| A、正己烷的分子是有毒的 |
| B、正己烷分子由碳、氢两种元素质量比为36:7 |
| C、正己烷的化学式为C6H14 |
| D、正己烷是由多原子分子构成的化合物 |



 表示的是
表示的是 水是人及一切生物生存所必需的,为了人类和社会经济的可持续发展,我们应该了解有关水的一些知识.请你回答:
水是人及一切生物生存所必需的,为了人类和社会经济的可持续发展,我们应该了解有关水的一些知识.请你回答: 如图为某化学反应的微观模拟图
如图为某化学反应的微观模拟图 分别表示氢原子、碳原子和氧原子.根据模拟图回答:
分别表示氢原子、碳原子和氧原子.根据模拟图回答: