题目内容
t℃时15g碳酸钙粉末与一定质量的盐酸恰好完全反应,反应后所得溶液为饱和溶液,此饱和溶液中溶质的质量分数为25%.求:
(1)所用盐酸中溶质的质量分数;
(2) t℃时反应后所得溶液中溶质的溶解度.
解:(1)设15gCaCO3消耗HCl的质量为x,生成CaCl2的质量为y,生成CO2的质量为z
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
15g x y z
 =
= =
= =
=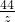
x=10.95g;y=16.65g;z=6.6g
反应后所得CaCl2饱和溶液的质量为:16.65g÷25%=66.6g
盐酸的质量为:66.6g+6.6g-15g=58.2g
盐酸中溶质的质量分数为: ×100%=18.8%
×100%=18.8%
(2)设t℃时CaCl2的溶解度为S
 ×100%=25%,
×100%=25%,
S=33.3g;
答:(1)盐酸中溶质的质量分数为18.8%;
(2)t℃时CaCl2的溶解度为33.3g.
分析:(1)欲求盐酸中溶质的质量分数,先求出盐酸溶质质量和溶液质量;
根据15g碳酸钙粉末与一定质量的盐酸恰好完全反应,可求出溶质盐酸的质量;
根据反应后所得氯化钙溶液饱和溶液的溶质的质量分数为25%和生成氯化钙的质量,求出饱和溶液的质量;
根据质量守恒定律,反应前后物质的质量相等的关系求得盐酸的质量;
根据溶质质量分数质量分数=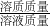 ×100%即可解答;
×100%即可解答;
(2)溶液中溶质的质量分数=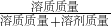 ×100% 进行分析解答.
×100% 进行分析解答.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
15g x y z
 =
= =
= =
=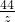
x=10.95g;y=16.65g;z=6.6g
反应后所得CaCl2饱和溶液的质量为:16.65g÷25%=66.6g
盐酸的质量为:66.6g+6.6g-15g=58.2g
盐酸中溶质的质量分数为:
 ×100%=18.8%
×100%=18.8%(2)设t℃时CaCl2的溶解度为S
 ×100%=25%,
×100%=25%,S=33.3g;
答:(1)盐酸中溶质的质量分数为18.8%;
(2)t℃时CaCl2的溶解度为33.3g.
分析:(1)欲求盐酸中溶质的质量分数,先求出盐酸溶质质量和溶液质量;
根据15g碳酸钙粉末与一定质量的盐酸恰好完全反应,可求出溶质盐酸的质量;
根据反应后所得氯化钙溶液饱和溶液的溶质的质量分数为25%和生成氯化钙的质量,求出饱和溶液的质量;
根据质量守恒定律,反应前后物质的质量相等的关系求得盐酸的质量;
根据溶质质量分数质量分数=
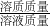 ×100%即可解答;
×100%即可解答;(2)溶液中溶质的质量分数=
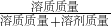 ×100% 进行分析解答.
×100% 进行分析解答.点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目