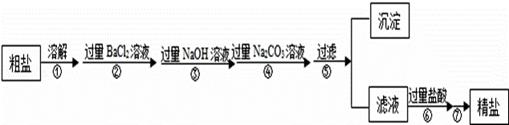
题目内容
甲烷(CH4)气体难溶于水,不与浓硫酸、硫酸铜、碱石灰(氢氧化钠和氧化钙的固体混合物)、澄清石灰水等起反应。甲烷具有还原性,在加热条件下与氧化铜发生反应,生成铜、水和二氧化碳。
某化学小组为验证甲烷的组成,设计了如下图所示实验。 该实验装置气密性良好,实验中所用试剂均足量。
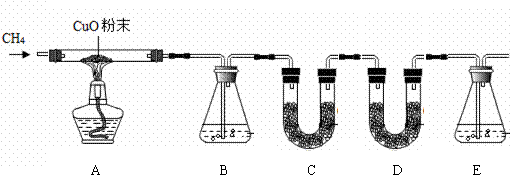 |
已知装置 B、C、D、E中分别盛有浓硫 酸、白色无水CuSO4固体、碱石灰、澄清石灰水,而且已知白色无水CuSO4固体遇水会变蓝色。
酸、白色无水CuSO4固体、碱石灰、澄清石灰水,而且已知白色无水CuSO4固体遇水会变蓝色。
(1)实验步骤:
I.通人甲烷气体。
Ⅱ.点燃酒精灯加热,反应一段时间后,停止加热。
Ⅲ.继续通甲烷至玻璃管冷却。
(2)有关现象:
①A中黑色固体变红色;②C中未见变蓝色;③E中未见出现浑浊。
(3)有关数据:
| A中玻璃管及物质总质量/g | B装置及物质总质量/g | D装置及物质总质量/g | |
| 反应前 | 108.0 | 212.0 | 131.0 |
| 反应后 | 106.4 | 212.9 | 132.1 |
请回答下列问题:
(1)实验室若用无水醋酸钠固体和碱石灰混合加热制取甲烷,则发生装置类型与 相同。
A.用石灰石与稀盐酸制二氧化碳 B.用过氧化氢制氧气 C.用高锰酸钾制氧气
(2)甲烷还原氧化铜的化学方程式为 。
(3)实验过程中通入甲烷的作用各不相同。步骤 I 是 ; 步骤Ⅱ 是还原氧化铜;步骤Ⅲ是 。
(4)请根据该实验数据列计算式,证明甲烷中不含氧元素。相关计算式为 。
(1) C
(2) CH4+4CuO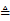 4Cu+2H2O+CO2
4Cu+2H2O+CO2
(3)排尽除去装置中的空气;将生成的气体全部排出,减小实验误差。
 (4)108.0g-106.4g=(212.9g-212.0g)16/18 + (131.1g-131.0g)32/44
(4)108.0g-106.4g=(212.9g-212.0g)16/18 + (131.1g-131.0g)32/44

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案某无色气体X可能含有氢气、一氧化碳、二氧化碳和甲烷四种气体中的一种或两种.为确认其组成,某同学取一定量该气体按如图所示装置进行实验(假设每步都充分反应或吸收),结果装置①中无明显变化,装置③增重1.8g,装置④增重2.2g.下列关于气体X成分的分析中,错误的是
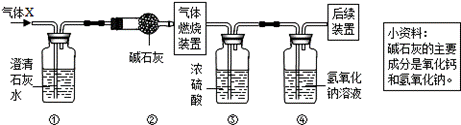 |
A.一定没有二氧化碳 B.可能含有甲烷和氢气
C.可能只有甲烷 D.可能含有氢气和一氧化碳
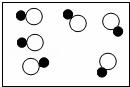
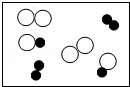
下列各图中,“ ”和“
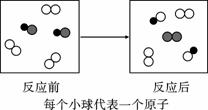
”和“ ”分别表示两种不同元素的原子,其中表示混合物的是( )
”分别表示两种不同元素的原子,其中表示混合物的是( )
|
| A. |
| B. |
| C. |
| D. |
|
铝元素与人类关系密切。
(1)如图是铝元素在元素周期表中的信息和铝原子的结构示意图。
 | |||
 | |||
铝元素的相对原子质量为 ;
铝原子在化学反应中容易 电子(填“得到”或“失去”)。
(2)铝元素在自然界中主要以Al2O3存在,Al2O3属于 (填标号)。
A.单质 B.氧化物 C.碱 D.盐
 (3)工业用电解熔融Al2O3的方法冶炼铝,化学方程式为:2Al2O3 4Al+3X↑,
(3)工业用电解熔融Al2O3的方法冶炼铝,化学方程式为:2Al2O3 4Al+3X↑,
X的化学为 ;该反应的基本类型为 反应。
(4)铝可制成蒸锅,主要利用铝的延展性和 性。
(5)药品“氢氧化铝[Al(OH)3]”片剂能与胃酸(主要成分为盐酸)发生中和反应,
治疗胃酸过多症,该 反应的化学方程式为 。
反应的化学方程式为 。
今年5月,南京某公司丢失一枚探伤用放射源铱﹣192,经过多方寻找终于放回安全箱.如图是元素周期表提供的铱元素的部分信息,下列说法正确的是()

|
| A. | 铱的原子序数为70 | B. | 铱原子的核电荷数为77 |
|
| C. | 铱的相对原子质量为192.2g | D. | 铱属于非金属元素 |

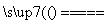 2CO2 化合反应
2CO2 化合反应 复分解反应
复分解反应 的浓度
的浓度 (1)该盐酸溶液中溶剂质量为 ▲ g;
(1)该盐酸溶液中溶剂质量为 ▲ g; 上述配制的盐酸溶液至完全反应,最
上述配制的盐酸溶液至完全反应,最 后测得生成气体的质量为4.4g。计算:①样品中碳酸钠的质量分数(结果精确到0.1%)
后测得生成气体的质量为4.4g。计算:①样品中碳酸钠的质量分数(结果精确到0.1%)