题目内容
1. A~G是初中常见的7种物质,它们有如图所示的转化关系.
A~G是初中常见的7种物质,它们有如图所示的转化关系.已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰.
(1)请写出下列物质的化学符号:DC,GSO2,HH2.
(2)请写出下列变化的化学方程式:①B→FC+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,②C→B2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
分析 已知A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,F为二氧化碳;结合过氧化氢和水均为无色液体,过氧化氢在二氧化锰的催化作用下生成水和氧气,碳是一种黑色固体,在氧气中燃烧生成二氧化碳,则A为过氧化氢,B为氧气,C为氧气,D为碳;E在纯净的B中燃烧发出明亮的蓝紫色火焰,结合硫在氧气中燃烧发出明亮的蓝紫色火焰,生成二氧化硫,则E为硫,G为二氧化硫;水通电分解生成氢气和氧气,则H为氢气;据此进行分析解答.
解答 解:A、C是无色液体,B、F、G是无色气体,其中大量排放F会引起温室效应,F为二氧化碳;过氧化氢和水均为无色液体,过氧化氢在二氧化锰的催化作用下生成水和氧气,碳是一种黑色固体,在氧气中燃烧生成二氧化碳,则A为过氧化氢,B为氧气,C为氧气,D为碳;E在纯净的B中燃烧发出明亮的蓝紫色火焰,硫在氧气中燃烧发出明亮的蓝紫色火焰,生成二氧化硫,则E为硫,G为二氧化硫;水通电分解生成氢气和氧气,则H为氢气.
(1)D、G、H的化学式分别是C、SO2、H2.
(2)①B→F,即碳在氧气中燃烧生成二氧化碳,反应的化学方程式为:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
②C→B,即水通电分解生成氢气和氧气,反应的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
故答案为:(1)C;SO2;H2;(2)①C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2;②2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | 它的1个分子中含有20个原子 | B. | 各元素质量比为C:H:N:O=54:7:7:8 | ||
| C. | 它的相对分子质量为150 | D. | 它是一种氧化物 |
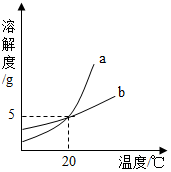 如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )
如图是a、b两种固体物质的溶解度曲线,下列说法中正确的是( )| A. | a的溶解度大于b的溶解度 | |
| B. | 在20℃时,a、b的溶液中溶质的质量分数相同 | |
| C. | a、b的溶解度都随温度升高而增大 | |
| D. | a、b都属于易溶物质 |
| A. | 二氧化锰 | B. | 高锰酸钾 | C. | 过氧化氢 | D. | 液氧 |
| A. | 氢气用来做高能燃料 | B. | 氢气用来做探空气球 | ||
| C. | 氩气用作焊接的保护气 | D. | 镁用来作照明弹 |



