题目内容
3. 如图为A、B两种固体物质的溶解度曲线.
如图为A、B两种固体物质的溶解度曲线.(1)从A物质的溶解度曲线可以得到哪些信息?(请写出其中-条)A固体物质的溶解度,是随温度升高而增大,或而B的溶解度随温度的升高而减少,或在t1℃时,A、B的溶解度相等.
(2)t2℃时,100g水中溶解25g A物质恰好饱和,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水125g.
(3)t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃时,此时所得A、B两物质溶液溶质的质量分数大小关系为A>B.
分析 根据题目信息和溶解度曲线可知:A固体物质的溶解度,是随温度升高而增大,而B的溶解度随温度的升高而减少;在t1℃时,A、B的溶解度相等;t2℃时,100g水中溶解25gA物质恰好饱和,若要把该饱和溶液稀释成质量分数为10%的溶液,设应加水质量为x,(125g+x)×10%=25g;x=125g;t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃时,此时所得A、B两物质溶液溶质的质量分数大小关系为A大于B.
解答 解:(1)由溶解度曲线可知:A固体物质的溶解度,是随温度升高而增大,或而B的溶解度随温度的升高而减少,或在t1℃时,A、B的溶解度相等;故答案为:A固体物质的溶解度,是随温度升高而增大,或而B的溶解度随温度的升高而减少,或在t1℃时,A、B的溶解度相等(合理即可);
(2)t2℃时,100g水中溶解25gA物质恰好饱和,若要把该饱和溶液稀释成质量分数为10%的溶液,设应加水质量为x,(125g+x)×10%=25g;x=125g;故答案为:25;125;
(3)t2℃时,分别将恰好饱和的A、B两种物质的溶液降温至t1℃时,此时所得A、B两物质溶液溶质的质量分数大小关系为A大于B,因为降温后B的质量分数不变,还是最小;故答案为:>;
点评 本考点考查了溶解度曲线及其应用,通过溶解度曲线我们可以获得很多信息;还考查了有关溶液和溶质质量分数的计算,有关的计算要准确,本考点主要出现在选择题和填空题中.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
13.如图是电解水的微观模型示意图,从中获得信息错误的是( )
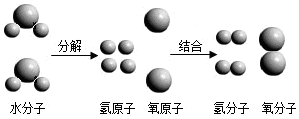

| A. | 水电解是化学变化 | B. | 分子由原子构成 | ||
| C. | 水电解前后原子的种类没有变化 | D. | 水分子是由氢分子和氧分子构成 |
14.如图为元素周期表中的一格,对图中信息解释正确的是( )
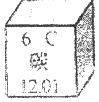

| A. | 核外电子数为12 | B. | 碳原子核内质子数为12 | ||
| C. | 核外电子数为6 | D. | 碳的相对原子质量为12.01g |
11.二氧化硫气体是造成酸雨的主要物质.为了探究二氧化硫能与水反应生成具有酸性的物质,四位同学设计了如下一组实验:取几朵用石蕊试液染成紫色的干燥的纸花,按图进行实验,观察纸花颜色的变化.下列有关的说法,你认为正确的是( )


| A. | 小雨同学认为,若实验Ⅰ中紫色小花变色,也不能证明酸性物质使紫色石蕊试液变红色 | |
| B. | 小军同学认为,实验Ⅱ的目的是证明水不能使紫色石蕊试液变红色 | |
| C. | 小涛同学认为,若实验Ⅲ中的紫色小花变色,则证明假设成立 | |
| D. | 小芳同学对实验方案提出了质疑,她认为还需补充一个实验才能使探究活动获得成功 |
8.下列物质的用途与性质不对应的是( )
| A. | 食品包装中用生石灰做干燥剂--CaO与水反应 | |
| B. | 书写档案规定必须使用碳素墨水--碳素墨水比较便宜 | |
| C. | 稀有气体能制成多种用途的电光源--稀有气体在通电时发出不同颜色的光 | |
| D. | 干冰可用做制冷剂--干冰升华吸热 |
15.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动,请你和他们仪器完成以下实验探究.
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想Ⅲ是正确的.
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
【演示实验】将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,该反应的化学方程式是Ca(OH)2+2HCl=CaCl2+2H2O.
【查阅资料】CaCl2溶液显中性
【提出问题】实验中未观察到明显显像,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
【猜想与假设】针对疑问,甲组同学猜想如下:
猜想Ⅰ:只有CaCl2;
猜想Ⅱ:有CaCl2和HCl;
猜想Ⅲ:有CaCl2和Ca(OH)2;
猜想Ⅳ:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想Ⅳ不合理,其理由是盐酸和氢氧化钙不能共存.
【实验探究】为了验证其余猜想,各小组进行了下列三个方案的探究.
| 实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
| 实验操作 | 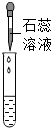 | 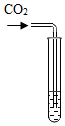 |  |
| 实验现象 | 溶液变为蓝色 | 溶液变浑浊 | 产生白色沉淀 |
| 实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
【评价反思】(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因碳酸钠与氯化钙也能产生碳酸钙白色沉淀.
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑反应物是否有剩余.
12.请从A或B两题中任选一个作答,若两题均作答,按35-A计分.
| A用浓硫酸配制100g 9.8%的稀硫酸 | B粗盐中难溶性杂质的去除 |
| (1)实验需要5.4mL浓硫酸和90mL水.量取两种液体用到的仪器有⑤⑥⑧(填序号). (2)稀释时,需将浓硫酸缓慢倒入水中,并不断进行搅拌,其原因是浓硫酸密度比水大,溶于水放出大量热,用玻璃棒不断搅拌,散热,防止液滴飞溅. | (1)过滤需要用到的仪器有②⑨⑪⑫(填序号). (2)蒸发过程中,需不断进行搅拌,其原因是防止局部温度过高,造成液体飞溅. |
| 可供选择的主要仪器: ①试管 ②烧杯 ③蒸发皿 ④托盘天平 ⑤10mL量筒 ⑥100mL量筒 ⑦药匙 ⑧胶头滴管 ⑨漏斗 ⑩酒精灯⑪铁架台⑫玻璃棒 | |
13.金刚石、石墨和C60的化学性质相似,物理性质却有很大差异.其主要原因是( )
| A. | 三种物质的组成元素种类不同 | B. | 构成它们的原子数目不同 | ||
| C. | 三种物质中碳原子的排列方式不同 | D. | 构成它们的原子大小不同 |