题目内容
5.根据下列粒子的结构示意图回答.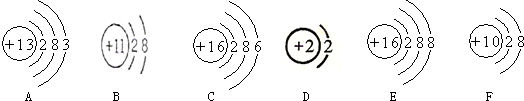
(1)具有相对稳定结构的粒子是BDEF.(填序号)
(2)表示同一种元素的粒子是CE.(填序号)
(3)在化学反应中易失去电子的粒子是A;(填序号)
(4)表示阳离子的是Na+(用离子符号表示);表示阴离子的是S2-(用离子符号表示)
(5)图中F(填序号)表示稀有气体元素的原子结构示意图.
(6)B、E粒子形成的化合物的化学式为Na2S;
(7)图中化学性质相似的是DF.
分析 (1)若粒子的最外层电子数为8,(氦为2个)属于相对稳定结构;
(2)元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,据此进行分析解答.
(3)最外层电子数小于4的原子易失去电子;
(4)根据质子数与电子数的特点分析回答;
(5)根据稀有气体元素的种类分析;
(6)根据B、E粒子的特点分析;
(7)根据最外层电子数主要决定元素的性质分析.
解答 解:(1)BCF的最外层电子数均为8,D的最外层也是第一层有2个电子,均具有相对稳定结构;
(2)元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,EF的质子数相同,属于同种元素.
(3)A的最外层电子数是1,在化学反应中易失去电子;
(4)在B中,质子数是11,电子数10.是钠离子属于阳离子,符号是Na+;在E中,质子数是16,电子数是18,是硫离子,属于阴离子,符号是:S2-.
(5)图中F质子数=核外电子数=10,为稀有气体原子.
(6)B是钠离子、E粒子是硫离子,形成的化合物为硫化钠,化学式为Na2S;
(7)图中DF到达了稳定结构,化学性质相似.
故答案为:(1)BCDF;B;(2)EF.(3)A(4)Na+,S2-;(5)F;(6)Na2S;(7)DF.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.

练习册系列答案
相关题目
16.中国女科学家屠嗷嗷发现并提炼出用于治疗疟疾的青蒿素( C15H22O5)、哈医大张亭栋教授发现砒霜(主要成分 As2O3)在治疗白血病方面的重要作用;这体现传统中医药在治疗疑难杂症方面的重要作用.下列有关说法正确的是( )
| A. | 青蒿素和三氧化二砷都属于氧化物 | |
| B. | 青蒿素和三氧化二砷都是由分子构成 | |
| C. | 碳、氢、氧原子保持青蒿素的化学性质 | |
| D. | 三氧化二砷中含有臭氧(O3)分子 |
13.下列实验现象描述正确的是( )
| A. | 红磷在空气中燃烧产生大量白雾 | |
| B. | 硫在氧气中燃烧发出明亮的蓝紫色火焰 | |
| C. | 电解水实验中,正极产生的气体体积是负极的2倍 | |
| D. | 碳在空气中燃烧生成二氧化碳 |
15.t℃时,将一定量KNO3的不饱和溶液平均分为三份,分别恒温蒸发出水的质量为5g、10g、15g,析出KNO3晶体的质量依次为a g、b g、c g,则a、b、c三者的关系为( )
| A. | c=a+b | B. | c=2b-a | C. | c=a+2 b | D. | c=2 a-b |
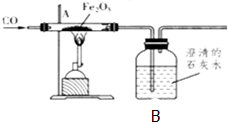 如图为研究冶炼铁的化学原理的装置,指出A、B处出现的现象,并写出化学反应方程式:
如图为研究冶炼铁的化学原理的装置,指出A、B处出现的现象,并写出化学反应方程式:
