题目内容
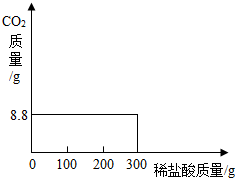
 我国青海湖地区有一种做法,冬天捞碱(Na2CO3),夏天晒盐(NaCl).化学小组的同学们也到盐湖捞了一些“碱”,回到实验室测定碳酸钠的含量.同学们取样品12克于烧杯中,向样品中逐滴加入稀盐酸,烧杯中物质的质量与所加盐酸的质量关系如图所示(提示:Na2CO3+2HCl=2NaCl+H2O+CO2↑,杂质只有食盐).请计算:
我国青海湖地区有一种做法,冬天捞碱(Na2CO3),夏天晒盐(NaCl).化学小组的同学们也到盐湖捞了一些“碱”,回到实验室测定碳酸钠的含量.同学们取样品12克于烧杯中,向样品中逐滴加入稀盐酸,烧杯中物质的质量与所加盐酸的质量关系如图所示(提示:Na2CO3+2HCl=2NaCl+H2O+CO2↑,杂质只有食盐).请计算:(1)反应生成二氧化碳的质量是
(2)样品中含碳酸钠的质量分数是
(3)完全反应时所得溶液(烧杯内无固体)中溶质的质量分数是
分析:(1)由曲线图知:加入稀盐酸50g时恰好完全反应,烧杯内剩余物质57.6g;反应后物质总质量减少,减少的质量为生成二氧化碳的质量.
(2)由二氧化碳的质量根据化学方程式可以计算出样品中碳酸钠的质量分数和生成氯化钠的质量.
(3)用原有氯化钠和生成氯化钠的质量和除以烧杯内剩余物质的质量即可得到所得溶液中溶质的质量分数.
(2)由二氧化碳的质量根据化学方程式可以计算出样品中碳酸钠的质量分数和生成氯化钠的质量.
(3)用原有氯化钠和生成氯化钠的质量和除以烧杯内剩余物质的质量即可得到所得溶液中溶质的质量分数.
解答:解:(1)生成二氧化碳的质量为
12g+50g-57.6g=4.4g
(2)设样品中碳酸钠的质量分数为x,生成氯化钠的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
12g?x y 4.4g
=
=
x≈88.3%,y=11.7g
(3)所得溶液中溶质的质量分数为
×100%≈22.7%
故答案为:(1)4.4g;(2)88.3%;(3)22.7%.
12g+50g-57.6g=4.4g
(2)设样品中碳酸钠的质量分数为x,生成氯化钠的质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
12g?x y 4.4g
| 106 |
| 12g?x |
| 117 |
| y |
| 44 |
| 4.4g |
x≈88.3%,y=11.7g
(3)所得溶液中溶质的质量分数为
| 12g×(1-88.3%)+11.7g |
| 57.6g |
故答案为:(1)4.4g;(2)88.3%;(3)22.7%.
点评:本题主要考查含杂质物质的化学方程式计算和溶质质量分数的计算,难度较大.

练习册系列答案
相关题目
 27、溶液在生产和科研中具有广泛的用途.请回答下列问题:
27、溶液在生产和科研中具有广泛的用途.请回答下列问题:
 (2003?扬州)在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3会含有少量的NaCl.
(2003?扬州)在我国青海湖地区有一种说法:冬天捞碱,夏天晒盐.这里的碱是指Na2CO3,盐是指NaCl.人们从盐湖中捞得的Na2CO3会含有少量的NaCl. 13、通过一年的学习,我能用学到的化学知识解决许多问题.
13、通过一年的学习,我能用学到的化学知识解决许多问题.