题目内容
 (1)小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图1所示(图中“--”表示相连的两种物质能发生反应).
(1)小政同学在复习Ca(OH)2化学性质时,归纳出了Ca(OH)2与其它物质间相互反应的关系如图1所示(图中“--”表示相连的两种物质能发生反应).①若X是与其它三种不同类别的化合物,则X的化学式可以是
②根据图中所示的物质间关系,写出其中发生“中和反应”的化学方程式:
③食醋中含3%~5%的醋酸,生活中常用食醋清洗水垢【Mg(OH)2和CaCO3】.
已知醋酸在水中能电离出CH3COO-和H+;2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O.请写出醋酸与Ca(OH)2反应的化学方程式:
(2)①用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图2所示.当加入熟石灰m g时,溶液中的溶质为
②若改用n g氢氧化钠与相同质量盐酸反应,所得溶液的pH
考点:碱的化学性质,中和反应及其应用,溶液的酸碱性与pH值的关系,书写化学方程式、文字表达式、电离方程式
专题:常见的碱 碱的通性
分析:(1)①根据碱的化学性质,碱能与酸反应,碱能与盐反应,碱能与酸性氧化物反应可解答此题;②根据中和反应发生的实质结合物质的转化关系,可以书写化学方程式.③根据信息可写出醋酸镁的化学式,进行正确写出化学方程式.
(2)①根据图象中pH值的变化是从小于7逐渐地增大到大于7,当加入溶液的质量为mg时,溶液的pH小于7,据此进行分析解答.
②根据反应的化学方程式可以确定物质间的质量关系,从而得知所得溶液的酸碱性.
(2)①根据图象中pH值的变化是从小于7逐渐地增大到大于7,当加入溶液的质量为mg时,溶液的pH小于7,据此进行分析解答.
②根据反应的化学方程式可以确定物质间的质量关系,从而得知所得溶液的酸碱性.
解答:解:(1)①因为我们学过碱的化学性质,碱能与酸反应,碱能与盐反应,碱能与酸性氧化物反应,又因为盐酸属于酸,碳酸钠属于盐,就少了酸性氧化物反应这种类型,所以我们可以选择学过的最常见的酸性氧化物二氧化碳,
②根据中和反应发生的实质,氢氧化钙与盐酸反应生成氯化钙和水;反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
③根据题中信息,因为钙和镁的离子都是+2价,所以醋酸镁和醋酸钙的化学式书写形式应该一样,为(CH3COO)2Mg;醋酸和氢氧化镁发生酸碱中和反应生成醋酸镁和水,化学方程式为:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O.
(2)①当加入熟石灰mg时,溶液的pH小于7,溶液显酸性,盐酸有剩余,溶液中的溶质是盐酸中的氯化氢和反应生成的氯化钙;
②NaOH+HCl═NaCl+H2O
40 36.5
Ca(OH)2+2HCl═CaCl2+2H2O
74 73
可以看出与相同的盐酸反应消耗氢氧化钠的质量多,当加入相同质量的氢氧化钠时,盐酸未全部参加反应,溶液呈酸性,pH小于7.
故答案为(1)①CO2; ②Ca(OH)2+2HCl═CaCl2+2H2O;
③2CH3COOH+Ca(OH)2=(CH3COO)2Ca+2H2O;
(2)①CaCl2和HCl;②<
②根据中和反应发生的实质,氢氧化钙与盐酸反应生成氯化钙和水;反应的化学方程式为:Ca(OH)2+2HCl═CaCl2+2H2O;
③根据题中信息,因为钙和镁的离子都是+2价,所以醋酸镁和醋酸钙的化学式书写形式应该一样,为(CH3COO)2Mg;醋酸和氢氧化镁发生酸碱中和反应生成醋酸镁和水,化学方程式为:2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O.
(2)①当加入熟石灰mg时,溶液的pH小于7,溶液显酸性,盐酸有剩余,溶液中的溶质是盐酸中的氯化氢和反应生成的氯化钙;
②NaOH+HCl═NaCl+H2O
40 36.5
Ca(OH)2+2HCl═CaCl2+2H2O
74 73
可以看出与相同的盐酸反应消耗氢氧化钠的质量多,当加入相同质量的氢氧化钠时,盐酸未全部参加反应,溶液呈酸性,pH小于7.
故答案为(1)①CO2; ②Ca(OH)2+2HCl═CaCl2+2H2O;
③2CH3COOH+Ca(OH)2=(CH3COO)2Ca+2H2O;
(2)①CaCl2和HCl;②<
点评:本题难度不大,主要考查了物质的化学性质和化学方程式的书写、中和反应及其应用,同时也考查了知识迁移的能力,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键.

练习册系列答案
相关题目
现在很多人都愿意使用铁锅做饭炒菜,其原因是 ( )
①铁具有良好的导热性 ②铁资源丰富,价格低廉 ③食物中增加微量铁元素 ④铁在干燥空气中不易生锈.
①铁具有良好的导热性 ②铁资源丰富,价格低廉 ③食物中增加微量铁元素 ④铁在干燥空气中不易生锈.
| A、只有① | B、只有② |
| C、①②③ | D、①②③④ |
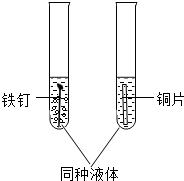 为了验证铁、铜两种金属的活动性差异,如图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
为了验证铁、铜两种金属的活动性差异,如图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )| A、蒸馏水 | B、稀盐酸 |
| C、酒精水溶液 | D、蔗糖溶液 |
微型录像带的磁粉主要成分是化合物CoFe2O4,(铁元素显一个价态)则其中钴元素(Co)的化合价为( )
| A、+2 | B、+3 | C、+5 | D、+6 |





