题目内容
9. 质量相等的两种金属a和b,它们都能与稀硫酸发生反应并产生氢气,反应情况如图所示,则下列有关a、b的活动性和参加反应的稀硫酸的质量的说法中,正确的是( )
质量相等的两种金属a和b,它们都能与稀硫酸发生反应并产生氢气,反应情况如图所示,则下列有关a、b的活动性和参加反应的稀硫酸的质量的说法中,正确的是( )①a比b活泼 ②b比a活泼 ③酸不足 ④酸过量.
| A. | ①② | B. | ③④ | C. | ①③ | D. | ②④ |
分析 金属越活泼,与稀硫酸反应需要的时间越短;
如果稀硫酸过量,质量相等的两种金属与稀硫酸完全反应后,生成氢气的质量应该不相等.
解答 解:由图中信息可知,a与稀硫酸反应的时间较短,因此a比b活泼;
因为生成氢气的质量相等,因此应该是稀硫酸不足,因为稀硫酸不足时,生成氢气的质量决定于稀硫酸的质量;
由分析可知,a比b活泼,稀硫酸不足.
故选:C.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
相关题目
17.1869年,俄国科学家门捷列夫对已发现60多种元素的性质进行了研究.当元素按照相对原子质量递增的顺序排列时,同列或同行元素的密度呈现规律性的变化,元素的相对原子质量与相邻(同列、同行)元素的相对原子质量也存在一定的关系.据此他预测了当时还未被发现元素的某些性质并被后来的实验所证明:
部分元素的相对原子质量和密度表
(1)由表中同列元素数据变化可得出:随着元素相对原子质量增大,元素的密度增大;
(2)现有未知元素X与硅和锡处于同一列且位于两者之间,与镓和砷处于同一行且位于两者之间,则未知元素X的相对原子质量约为73.
部分元素的相对原子质量和密度表
| 元素关系 | 同列元素 | 未知元素X的相邻元素 | |||||
| 元素名称 | 钙 | 锶 | 钡 | 硅 | 镓 | 砷 | 锡 |
| 相对原子质量 | 40 | 88 | 137 | 28 | 70 | 75 | 119 |
| 密度(克/厘米3) | 1.55 | 2.60 | 3.62 | 2.40 | 5.89 | 5.72 | 7.30 |
(2)现有未知元素X与硅和锡处于同一列且位于两者之间,与镓和砷处于同一行且位于两者之间,则未知元素X的相对原子质量约为73.
14.常温下MFe2Ox(3<x<4)新型纳米材料能使工业废气中的SO2转化为S,反应过程如下:MFe2Ox+SO2═MFe2Oy+S 其中M表示+2价的金属元素.已知MFe2Oy中Fe的化合价为+3价,M在该反应中化合价不变.下列说法错误的是( )
| A. | MFe2Ox可用于环保 | |
| B. | 反应方程式中只有一种物质属于氧化物 | |
| C. | y的数值为4 | |
| D. | 该反应中只有硫元素的化合价发生了变化 |
1.刚刚结束的全国两会与3月15日胜利闭幕,其中环保是今年两会的关注问题之一,建设社会主义新农村的新目标之一是让农民饮用清洁的自来水.自来水消毒过程中常会发生甲、乙化学反应,其反应的微观过程可用如图表示.下列说法正确的是( )
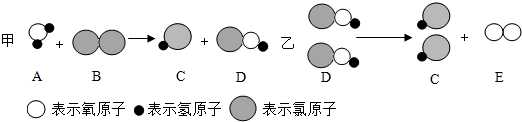

| A. | 物质D属于氧化物 | B. | 物质C的水溶液pH大于7 | ||
| C. | 甲属于复分解反应 | D. | 实验室可用H2O2和MnO2制取E |
18.一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3.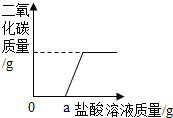
(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是NaOH和Na2CO3混合物;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
计算该样品中Na2CO3的质量分数(写出计算过程).
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量.测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示. 请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量等于变质后消耗盐酸的量(填“大于”、“小于”或“等于”).

(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是NaOH和Na2CO3混合物;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量.测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示. 请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量等于变质后消耗盐酸的量(填“大于”、“小于”或“等于”).




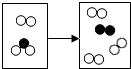 如图是密闭体系中某反应的微观示意图,“
如图是密闭体系中某反应的微观示意图,“ ”和“
”和“ ”分别表示微粒.
”分别表示微粒. B、
B、 C、
C、 D、
D、
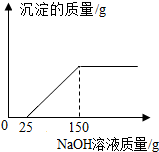 现有16g Fe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100克足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题:
现有16g Fe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100克足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题: