题目内容
15. A、B、C、D、E均为初中化学常见的纯净物,它们分别属于不同类别,C是胃酸的主要成分,A、B中含有相同金属元素,E的溶液pH>7,它们之间的转化关系如图所示.图中“-”表示相连的物质之间可以发生化学反应,“→”表示由某物质可转化为另一种物质.(部分反应物、生成物及反应条件已略去)
A、B、C、D、E均为初中化学常见的纯净物,它们分别属于不同类别,C是胃酸的主要成分,A、B中含有相同金属元素,E的溶液pH>7,它们之间的转化关系如图所示.图中“-”表示相连的物质之间可以发生化学反应,“→”表示由某物质可转化为另一种物质.(部分反应物、生成物及反应条件已略去)请回答下列问题:
(1)A的化学式是Fe2O3.
(2)B与C反应的化学方程式是Fe+2HCl═FeCl2+H2↑,反应的现象是有气泡产生,溶液由无色变为浅绿色.
(3)E→D反应的化学方程式是Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(4)C与E反应的微观本质是CO32-+2H+=H2O+CO2↑.
分析 根据题干提供的信息分析解答,A、B、C、D、E属于不同类别,C是胃酸的主要成分,故C是盐酸,A、B中含有相同金属元素,且AB能与C反应,E的溶液pH>7,显碱性,能与盐酸反应,D也能与酸反应,能与酸反应的物质有金属、金属氧化物、盐和碱,B能生成A,E能生成D,故B可能是铁,A可能是氧化铁,E如果是碳酸钠,D可能是氢氧化钠,符合物质类别不同,据此解答.
解答 解:A、B、C、D、E属于不同类别,C是胃酸的主要成分,故C是盐酸,A、B中含有相同金属元素,且AB能与C反应,E的溶液pH>7,显碱性,能与盐酸反应,D也能与酸反应,能与酸反应的物质有金属、金属氧化物、盐和碱,B能生成A,E能生成D,故B可能是铁,A可能是氧化铁,E如果是碳酸钠,D可能是氢氧化钠,符合物质类别不同,带入框图,推断合理;
(1)A是氧化铁,故填:Fe2O3;
(2)B是铁,C是盐酸,铁能与盐酸反应生成氯化亚铁和氢气,氯化亚铁的水溶液为浅绿色,故填:Fe+2HCl═FeCl2+H2↑;有气泡产生,溶液由无色变为浅绿色;
(3)E是碳酸钠,D是氢氧化钠,碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故填:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(4)C是盐酸,E是碳酸钠,二者反应的实质是碳酸钠中的碳酸根离子和盐酸中的氢离子结合产生二氧化碳和水,故填:CO32-+2H+=H2O+CO2↑.
点评 在解此类题时,根据题中的条件结合物质的性质进行推断即可.要求同学们加强对常见物质性质的掌握,以便灵活应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列说法正确的是( )
| A. | 使用催化剂可以生成更多的产物 | |
| B. | 因为水分子中含有氧原子,所以凉开水可以养鱼 | |
| C. | 稀有气体的化学性质不活泼,可作灯泡保护气 | |
| D. | 空气的污染物有可吸入颗粒物、二氧化硫、二氧化碳和二氧化氮等 |
3.与碳元素有关的下列物质中,由原子构成的是( )
| A. | C60 | B. | 石墨 | C. | CO2 | D. | Na2CO3 |
10.下列实验方案一定能达到实验目的是( )
| 选项 | 实验目的 | 实验方法 |
| A | 鉴别纯铝和硬铝 | 取样,加入少量硫酸铜溶液 |
| B | 除去二氧化碳中的一氧化碳 | 将气体点燃 |
| C | 检验硝酸钠溶液中是否有氯化钠 | 取样,滴加少量硝酸溶液 |
| D | 探究电解水后生成的气体 | 用带火星的木条检验电源负极端的气体 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
20.空气、水都是宝贵的自然资源,以下关于空气和水的叙述中正确的是( )
| A. | 随意丢弃塑料袋会造成白色污染 | B. | 氧气约占空气体积的78% | ||
| C. | 废水无色透明就可以直接排放 | D. | 淡水资源取之不尽 |
7.丁酸乙酯(C6H12O2)是无色具有菠萝香味的液体,常用作食品、饮料的调香剂.下列有关丁酸乙酯的叙述正确的是( )
| A. | 丁酸乙酯是由碳、氢、氧三种原子构成的 | |
| B. | 丁酸乙酯中碳、氢、氧三种元素的质量比为3:6:1 | |
| C. | 丁酸乙酯中碳元素的质量分数为31% | |
| D. | 一个丁酸乙酯分子中含有20个原子 |
4.2017年世界地球日的主题是“节约集约利用资源 倡导绿色简约生活--讲好我们的地球故事”下列说法不正确的是( )
| A. | 改变农村各自取暖的现状,提倡集体供暖 | |
| B. | 改变出行方式,提倡绿色出行 | |
| C. | 采用“绿色化学”工艺,使原料尽可能转化为所需的物质 | |
| D. | 为减少空气污染,禁止使用化石燃料 |
5.现有失去标签的两瓶无色固体:烧碱固体和纯碱固体.某兴趣小组设计用化学方法和物理方法区分它们.请回答有关问题:
(1)化学方法按表中方法一填写.所选试剂须属不同物质类别.
(2)物理方法(简要叙述操作方法和判断方法)取样分别溶于水,温度明显升高的是烧碱,温度没有明显改变的是纯碱.
(1)化学方法按表中方法一填写.所选试剂须属不同物质类别.
| 物质类别 | 所选试剂 | 判断方法 |
| 酸 | 盐酸 | 取样分别与盐酸反应,有气体生成的是纯碱,没气体的是烧碱. |
| 碱 | ||
| 盐 |
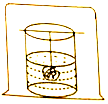 如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).
如图所示,在一个温度不变的密闭容器内,放入一杯饱和硫酸铜溶液,用细线吊住一块有缺口的硫酸铜晶体并浸在溶液中.过几天后观察到:晶体上的缺口没有(填“有”或“没有”)存在,晶体的质量不变(填“减小”、“增大”或“不变”).