题目内容
14. 如图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物省略).按下列要求填空:
如图是某同学对二氧化碳部分知识构建的网络图(部分反应条件和部分生成物省略).按下列要求填空:(1)写出a燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
(2)物质d的化学式是H2CO3.
(3)二氧化碳转化为C属于化学变化(填“物理”或“化学”).
(4)固体二氧化碳称为干冰,可用于人工降雨.
(5)二氧化碳过多会引起温室效应,有研究指出可用地下盐水储存CO2,此过程中设计到反应2Mg2SiO4+2H2O+CO2═Mg3Si2O5(OH)4+X,则生成物X 为MgCO3(填化学式).
(6)含碳物质燃烧会污染空气,研制的开发不含碳并可用于工业生产和清洁能源,一直是科学家不懈追求的目标,氮气(NH3)在空气中充分燃烧的产物是氮气和水,目前液氮被人们称为一种潜在的清洁燃料.
液氨和液氢燃料相比有关数据见下表,据此判断不正确的是A(填序号)
| 燃料 | 沸点(℃) | 燃烧放热(kJ/g) | 相对分子质量 | 气体含量爆炸范围 | 液态密度(g/cm3) |
| 氢 | -252.6 | 119.20 | 2.0 | 4.0%~75.6% | 0.07 |
| 氨 | -33.50 | 18.65 | 17.0 | 16%~25% | 0.61 |
B.以氨和氢为燃料时,可以减缓温室效应
C.氨的液化比氢容易得多
D.等质量的氨和氢分别燃烧,氢放出的热量多.
分析 (1)根据天然气的主要成分是甲烷进行分析;
(2)根据二氧化碳和水反应生成碳酸进行分析;
(3)根据变化的特征分析回答;
(4)根据固体二氧化碳称为干冰分析回答;
(5)根据质量守恒定律反应清喉原子的种类及数目不变分析生成物X的化学式;
(6)A、根据氨气和氢气的性质分析;
B、根据燃烧的产物分析;
C、根据沸点分析;
D、根据燃烧放热的情况分析.
解答 解:(1)a是天然气,主要成份是甲烷,燃烧生成了二氧化碳和水,反应的化学方程式是:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2 H2O.
(2)二氧化碳和水反应生成碳酸,碳酸的化学式为:H2CO3;
(3)二氧化碳转化为C,有新物质生成,属于化学变化;
(4)固体二氧化碳称为干冰,可用于人工降雨.
(5)在反应2Mg2SiO4+2H2O+CO2═Mg3Si2O5(OH)4+X中,反应前含有4个Mg原子,2个Si原子,12个O原子,4个H原子,1个O原子,反应后含有3个Mg原子,2个Si原子,9个O原子,4个H原子,故X中含有一个Mg原子,1个C原子,3个O原子,则生成物X为:MgCO3;
(6)A.氢气容易和氧气发生反应,而氨气不易和氧气反应,且氨气有特殊的气味,容易被发觉,因此氢气更易发生爆炸,故说法错误;
B.以氨和氢为燃料时,反应物中没有碳元素,因此不会产生二氧化碳,可以减缓温室效应,故说法正确;
C.氨的沸点比氢气高的多,因此氨的液化比氢容易得多,故说法正确;
D.从表格可以看出,等质量的氨和氢分别燃烧,氢放出的热量多,故说法正确.
故答为:(1)CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2 H2O;(2)H2CO3;(3)化学;(4)干冰 (5)MgCO3;(6)A.
点评 碳及碳的化合物是物质世界最大的一个家庭,也是初中阶段非常重要的一个内容,我们要熟悉其相互转化关系.

 阅读快车系列答案
阅读快车系列答案| A. |  加热液体 | B. |  倾倒液体 | C. |  点燃酒精灯 | D. |  量取液体 |
| A. | 氢氧化钠用于治疗胃酸过多 | B. | 氯化钠可用于配制生理盐水 | ||
| C. | 在实验室,浓硫酸常用来做干燥剂 | D. | 熟石灰可用来改良酸性土壤 |
| A. | 硫在氧气中燃烧 | B. | 石蜡在空气中燃烧 | ||
| C. | 给高锰酸钾加热 | D. | 红磷在空气中燃烧 |
| A. | 氧(O) | B. | 硅(Si) | C. | 铝(Al) | D. | 铁(Fe) |
| A. | 干冰新华、 | B. | 汽油燃烧 | C. | 美酒飘香 | D. | 酒精挥发 |

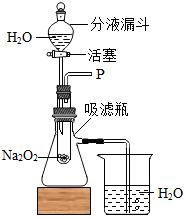 在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究.
在学校的元旦联欢会上,某同学表演了“水能生火”的魔术.他向包有过氧化钠(Na2O2)粉末的脱脂棉上滴水,脱脂棉燃烧起来.小蔡很感兴趣,于是,他和同学们进行探究.