题目内容
【题目】已知 A~G 是初中化学常见的物质,A 通常为黑色粉末,C 为无色气体,E 常用于制肥皂,G 为目前世界上年产量最高的金属,若用 “—”表示两种物质能发生反应,用“![]() ”表示一种物质能转化为另一种物质,
”表示一种物质能转化为另一种物质,![]() 表示相互转化,且有些反应需在溶液中进行。请回答下列问题:
表示相互转化,且有些反应需在溶液中进行。请回答下列问题:

(1)请写出物质(溶质)的化学式:B__________________;D______________;E________________;G___________________;
(2)硫酸铜溶液与片状固体 G 反应的现象是___________________;
(3)A 与 C 反应的化学方程式为______________。
【答案】H2SO4 H2O NaOH Fe 银白色固体表面覆盖一层紫红色固体,溶液由蓝色(逐渐)变为浅绿色 H2+ CuO![]() Cu+H2O
Cu+H2O
【解析】
根据题干提供的信息:G为目前世界上年产量最高的金属,故G是铁,铁能与B反应,B能生成气体C,B能生成硫酸铜,故B可以是稀硫酸,C为氢气,A通常为黑色粉末,能与B反应,故A可以是氧化铜,E常用于制肥皂,能与稀硫酸和硫酸铜反应,故E是氢氧化钠,硫酸、氧化铜都能生成D,且D能与氢气相互转化,故D可以是水,代入验证,推导合理。
(1)B是H2SO4;D是H2O;E是NaOH;G是Fe;
(2)硫酸铜溶液与片状固体G(铁)反应是铁和硫酸铜反应,现象是银白色固体表面覆盖一层紫红色固体,溶液由蓝色变为浅绿色;
(3)A与C反应是氧化铜和氢气加热生成铜和水,化学方程式为H2+ CuO![]() Cu+H2O。
Cu+H2O。

 名校课堂系列答案
名校课堂系列答案【题目】石灰石高温煅烧获得的生石灰是炼钢生产中的主要碱性造渣材料,其活性度好坏对冶炼过程有重要影响。
(提出问题)哪些因素可能影响生石灰的活性度?
(查阅资料)生石灰活性度体现了生石灰与其他物质的反应能力,是表征生石灰水化反应速度的一个指标。生产中常用的检测标准定义为:在足够时间内,用中和生石灰消化时产生的Ca(OH)2所消耗的盐酸的体积数(单位为mL)表示。
(进行实验)
实验1:相同条件下,煅烧不同石灰石,测生石灰的活性度。
产地 | 石灰石 | 生石灰 | |
外观 | CaO含量/% | 活性度/mL | |
A地 | 灰白色 | 94.89 | 391 |
B地 | 灰白色带少量红棕色 | 89.97 | 375 |
实验2:取某石灰石试样,在电炉内进行煅烧,烧成后测定生石灰的活性度。
时间/min | 各煅烧温度下的生石灰活性度/mL | |||||
1050℃ | 1100℃ | 1150℃ | 1200℃ | 1250℃ | 1300℃ | |
12 | 790 | 836 | 868 | 808 | 454 | 412 |
16 | 793 | 856 | 871 | 845 | 556 | 530 |
20 | 795 | 863 | 873 | 864 | 617 | 623 |
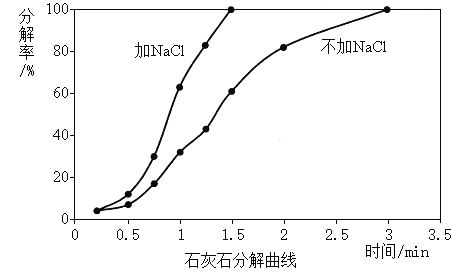
实验3:煅烧温度1050℃时,加NaCl和不加NaCl,比较煅烧石灰石的分解率(分解率影响生石灰活性度)。
(解释与结论)
(1)实验1的目的是___________。
(2)能证明最佳煅烧温度为1100~1200℃的证据是__________。
(3)实验3的结论是_________。
(反思与评价)
(4)写出石灰石高温分解生成生石灰和另一种氧化物的化学方程式_________。
(5)除以上研究的可能影响生石灰活性度的因素外,你认为还可以研究的其他因素有_______(写出一条即可)。