题目内容
7.(1)金属材料在生活、生产中应用非常广泛,请仔细看如图 并填空: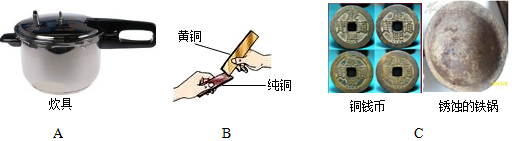
①图 A 主要是利用了金属的导热性;
②金属材料大多是合金而不是纯金属,这是因为合金具有更多优良性能.图 B 中黄铜 比纯铜硬度大(填“大”或“小”);
③400 多年前的古沉船“南澳一号”成功打捞.图 C 是古船上部分文物图片,锈蚀的铁锅可以用稀盐酸除去铁锈,稀盐酸除锈的化学方程式为Fe2O3+6HCl═2FeCl3+3H2O;
铁锅生锈的条件是铁和水、氧气同时接触.
(2)已知金属 M 和 N 能够发生如下反应:M+H2SO4=MSO4+H2↑、Fe+MCl2=M+FeCl2、N+FeCl2=Fe+NCl2,判断 Fe、Cu、M、N 的活动性由强到弱的 顺序是N>Fe>M>Cu;以上三个化学反应均属于置换反应(填基本反应类型).
(3)向 AgNO3 和 Cu(NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸 无明显现象.下列说法正确的是C(填序号).
A.一定有锌粉剩余B.所得溶液中一定有 Zn2+、Cu2+
C.一定有银粉生成D.所得溶液中一定有 Cu2+、Ag+.
分析 (1)金属具有良好的导电性、导热性和延展性;
合金相对于组成成分来说,优点有硬度大、密度小、机械强度高、耐腐蚀性强等;
铁和水、氧气同时接触时容易生锈,铁锈的主要成分是氧化铁,能和稀盐酸反应生成氯化铁和水;
(2)根据反应情况可以判断金属活动性顺序;
(3)铁比铜活泼,铜比银活泼.
解答 解:(1)①图A主要是利用了金属的导热性.
故填:导热.
②金属材料大多是合金而不是纯金属,这是因为合金具有更多优良性能.图B中黄铜属于合金,比纯铜硬度大.
故填:大.
③铁锈的主要成分是氧化铁,能和稀盐酸反应生成氯化铁和水,反应的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O;
铁锅生锈的条件是铁和水、氧气同时接触.
故填:Fe2O3+6HCl═2FeCl3+3H2O;铁和水、氧气同时接触.
(2)M+H2SO4=MSO4+H2↑,说明M在金属活动性顺序中排在氢的前面,Fe+MCl2=M+FeCl2,说明铁比M活泼,N+FeCl2=Fe+NCl2,说明N比铁活泼,铜在金属活动性顺序表中排在氢的后面,因此 Fe、Cu、M、N 的活动性由强到弱的顺序是N>Fe>M>Cu,以上三个化学反应均属于置换反应.
故填:N>Fe>M>Cu;置换反应.
(3)向 AgNO3 和 Cu(NO3)2混合溶液中加入一定量的锌粉,锌先和硝酸银反应生成硝酸锌和银,如果锌足量,再和硝酸铜反应生成硝酸锌和铜,充分反应后再加入稀盐酸无明显现象,说明硝酸银和锌都已经完全反应;
A.加入稀盐酸无明显现象,说明一定没有锌粉剩余,该选项说法不正确;
B.所得溶液中一定有反应生成的Zn2+,不一定有Cu2+,该选项说法不正确;
C.一定有反应生成的银粉,该选项说法正确;
D.加入稀盐酸无明显现象,说明所得溶液中一定没有Ag+,可能有Cu2+,该选项说法不正确.
故选:C.
点评 要会利用金属活动顺序表分析实验,氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

 名校课堂系列答案
名校课堂系列答案| A. | Na2CO3→NaCl→NaNO3→NaOH | B. | C→CO→Fe→Fe2O3 | ||
| C. | Cu→CuO→CuSO4→Cu(OH)2 | D. | CaCO3→CaO→Ca(OH)2→NaOH |
| 实验序号 | 第一次 | 第二次 | 第三次 | 第四次 |
| 加入稀盐酸的质量/g | 20 | 20 | 20 | 20 |
| 反应后烧杯中剩余物质的质量/g | 37.8 | 55.6 | 74.5 | 94.5 |
(1)产生CO2气体的总质量;
(2)样品中氯化钠的百分含量;
(3)使用的稀盐酸的溶质质量分数.
| A. | 锌可以与稀盐酸反应生成氢气,所以锌也可以与稀硫酸反应生成氢气 | |
| B. | 中和反应生成盐和水,故生成盐和水的反应一定是中和反应 | |
| C. | 碱溶液能使无色酚酞溶液变红,则能使无色酚酞溶液变红的溶液一定是碱溶液 | |
| D. | 硫酸可以与BaCl2反应生成沉淀,所以盐酸也可以与BaCl2反应生成沉淀 |
| A. | CO | B. | K2S | C. | NO | D. | SO2 |
| A. | 是一种氧化物 | |
| B. | 由C、H、O三种元素组成 | |
| C. | 由2个碳原子、2个氧原子和4个氢原子构成 | |
| D. | 相对分子质量为60g |
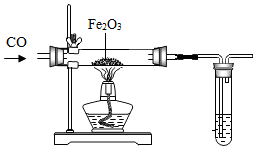 冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法.
冶炼金属通常是指从矿石中提取金属单质的过程,除“沙土淘金”等物理方法外,金属冶炼大都是使金属从其化合态(化合物)转化为游离态(单质)的化学过程.根据金属的化学性质不同,工业上冶炼金属一般有以下几种方法.