题目内容
3.地球是一颗美丽的蓝色星球,海水占了全球水资源的97%.海水资源的开发和利用具有非常广阔的前景.(1)海水中含有大量的NaCl,可用于制备钠及其化合物,其流程如图:
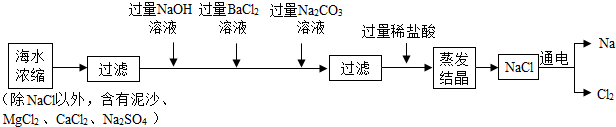
①上述过程中使用了过滤和蒸发操作,实验室中这两个操作均会使用到的玻璃仪器是玻璃棒.
②加入过量Na2CO3溶液目的是除去CaCl2和氯化钡,流程中不能用过量稀硫酸代替过量稀盐酸的原因是会生成新的杂质硫酸钠.
(2)根据以上信息,写出制取金属钠的化学方程式2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑.
(3)工业上利用电解饱和食盐水制备NaOH的方程式为:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
该电解原理与实验室电解水类似,由此推测,电解食盐水时电源正极一端产生的气体是Cl2.
分析 (1)①根据碳酸根离子和钙离子、钡离子会生成碳酸钙沉淀、碳酸钡沉淀,硫酸和氢氧化钠、碳酸钠会生成硫酸钠进行分析;
②根据蒸发、过滤过程中需要的玻璃仪器进行分析;
③根据氯化钠在通电的条件下生成钠和氯气进行分析;
(2)根据氯化钠溶液在通电的条件下生成氢氧化钠、氯气和氢气,依据电荷同性相斥,异性相吸的原则进行分析.
解答 解:(1)①碳酸根离子和钙离子、钡离子会生成碳酸钙沉淀、碳酸钡沉淀,所以加入过量Na2CO3溶液目的是除去CaCl2和氯化钡,硫酸和氢氧化钠、碳酸钠会生成硫酸钠,所以不能用过量稀硫酸代替过量稀盐酸的原因是会生成新的杂质硫酸钠;
②蒸发过程中用到的玻璃仪器有玻璃棒、酒精灯,过滤过程中用到的玻璃仪器有烧杯、漏斗、玻璃棒,所以两步操作中需要的玻璃仪器有玻璃棒;
③氯化钠在通电的条件下生成钠和氯气,化学方程式为:2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑;
(2)氯化钠溶液在通电的条件下生成氢氧化钠、氯气和氢气,化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,电荷同性相斥,异性相吸,所以电解食盐水时电源正极一端产生的气体是Cl2.
故答案为:(1)①BaCl2,会生成新的杂质硫酸钠;
②玻璃棒;
③2NaCl$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑;
(2)Cl2.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中所给的知识进行解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18. 已知:①CO2+H2O+Na2CO3=2NaHCO3;
已知:①CO2+H2O+Na2CO3=2NaHCO3;
②某些含钠元素的化合物在20℃时的溶解度如下表:
(1)实验室选用如图所示装置,用大理石和稀盐酸反应制取CO2,盐酸应该通过长颈漏斗(填仪器名称)添加到相应的反应器中,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2+H2O.用该方法制得的CO2气体中含有少量水蒸气及杂质气体.为得到纯净、干燥的CO2气体,应先将混合气体通过盛有C(选填A、B、C、D、E字母,下同)的洗涤装置,然后,再将气体通过盛有E的洗涤装置.
A.氯化钠饱和溶液 B.碳酸钠饱和溶液 C.碳酸氢钠饱和溶液 D.水 E.浓硫酸
(2)现向20℃时100.00g 13.25%的碳酸钠溶液中通入足量的CO2.
①最终得到碳酸氢钠的总质量为21g;
②列式计算最后所得溶液中碳酸氢钠的质量.
 已知:①CO2+H2O+Na2CO3=2NaHCO3;
已知:①CO2+H2O+Na2CO3=2NaHCO3;②某些含钠元素的化合物在20℃时的溶解度如下表:
| 物质 | 碳酸钠 | 碳酸氢钠 | 氢氧化钠 |
| 溶解度 | 21.8g | 9.6g | 109.0g |
A.氯化钠饱和溶液 B.碳酸钠饱和溶液 C.碳酸氢钠饱和溶液 D.水 E.浓硫酸
(2)现向20℃时100.00g 13.25%的碳酸钠溶液中通入足量的CO2.
①最终得到碳酸氢钠的总质量为21g;
②列式计算最后所得溶液中碳酸氢钠的质量.
4.资料表明:在不同温度下,CO可将Fe2O3还原Fe、Fe3O4中的一种或两种.
为探究温度对该反应产物的影响,进行如下实验:
【查阅资料】
Ⅰ.Fe3O4与盐酸反应,得到FeCl2和FeCl3的混合溶液
Ⅱ.用溶质质量分数一定的FeCl2和FeCl3溶液进行如下实验,为方案设计提供参考
【实验过程】
甲、乙两组同学分别用酒精灯和酒精喷灯作为热源进行CO还原Fe2O3的实验,检验得到的黑色固体的成分,实验记录如下.
【实验反思】
(1)结合此次探究活动,你认为下列说法正确的是abcd(填序号).
a.温度会影响反应的产物
b.试剂A用于检验FeCl3溶液
c.进行CO还原Fe2O3的实验时,一定要进行尾气处理
d.得到的黑色固体的质量一定小于参加反应的Fe2O3的质量
(2)有人认为乙组的实验结论有欠缺,你是否认同此观点,其理由是实验结论有欠缺,因为如果黑色固体是铁和四氧化三铁的混合物,加入稀盐酸时,四氧化三铁和稀盐酸反应生成的氯化铁能和铁反应生成氯化亚铁,加试剂A后,溶液颜色无明显变化.
为探究温度对该反应产物的影响,进行如下实验:
【查阅资料】
Ⅰ.Fe3O4与盐酸反应,得到FeCl2和FeCl3的混合溶液
Ⅱ.用溶质质量分数一定的FeCl2和FeCl3溶液进行如下实验,为方案设计提供参考
| FeCl2溶液 | FeCl3溶液 | |
| 加入Fe | 无明显变化 | 溶液变成浅绿色 |
| 加试剂A | 无明显变化 | 溶液变成红色 |
甲、乙两组同学分别用酒精灯和酒精喷灯作为热源进行CO还原Fe2O3的实验,检验得到的黑色固体的成分,实验记录如下.
| 实验操作 | 实验现象 | 结论与解释 |
| ①取少量的黑色固体于试管中,滴加适量的 稀盐酸 ②向步骤①所得的溶液中,滴加试剂A | 甲组: 固体溶解,无气泡冒出 加试剂A后,溶液变成红色 | 黑色固体的成分是四氧化三铁, 甲组用CO还原Fe2O3反应的化学方程式是3Fe2O3+CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe3O4+CO2 |
| 乙组: 固体溶解,产生气泡; 加试剂A后,溶液颜色无明显变化 | 黑色固体的成分是Fe |
(1)结合此次探究活动,你认为下列说法正确的是abcd(填序号).
a.温度会影响反应的产物
b.试剂A用于检验FeCl3溶液
c.进行CO还原Fe2O3的实验时,一定要进行尾气处理
d.得到的黑色固体的质量一定小于参加反应的Fe2O3的质量
(2)有人认为乙组的实验结论有欠缺,你是否认同此观点,其理由是实验结论有欠缺,因为如果黑色固体是铁和四氧化三铁的混合物,加入稀盐酸时,四氧化三铁和稀盐酸反应生成的氯化铁能和铁反应生成氯化亚铁,加试剂A后,溶液颜色无明显变化.
2.水是生命的源泉,也是不可缺少的资源.
(1)某矿泉水的主要矿物质成分及含量如表,这里Ca、K、Zn、F是指元素(填“单质、元素、分子或原子”).
(2)水污染日益严重,水资源的保护和合理利用已受到人们的普遍关注.请参与讨论下列有关问题:
(Ⅰ)自来水、蒸馏水、海水中属于纯净物的是蒸馏水.
(Ⅱ)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如图所示:

①对应的作用是B(填字母序号,下同
A.杀菌消毒 B.吸附杂质 C.沉淀过滤 D.蒸馏
(Ⅲ)下列做法会造成水体污染的有AD.
A.工业废水直接排放 B.工业废气处理后排放
C.禁止使用含磷洗衣粉 D.大量使用化肥、农药
(Ⅳ)能确认水是由氧元素和氢元素组成的实验是AC.
A.氢气在氧气中燃烧生成水 B.水的蒸发 C.水的电解 D.水的净化
(3)长期饮用硬水可能会引起体内结石,鉴别硬水和软水最简单的鉴别方法是用肥皂水鉴别.
(4)水通电分解生成最理想的能源-氢气,电解一定量的水,当其中负极产生5mL气体时,正极产生的气体体积是2.5mL.
(1)某矿泉水的主要矿物质成分及含量如表,这里Ca、K、Zn、F是指元素(填“单质、元素、分子或原子”).
| 成分 | Ca | K | Zn | F |
| 含量(mg/L) | 20 | 3 | 0.06 | 0.02 |
(Ⅰ)自来水、蒸馏水、海水中属于纯净物的是蒸馏水.
(Ⅱ)某学校饮水处可以将自来水净化为饮用水,其中处理步骤如图所示:

①对应的作用是B(填字母序号,下同
A.杀菌消毒 B.吸附杂质 C.沉淀过滤 D.蒸馏
(Ⅲ)下列做法会造成水体污染的有AD.
A.工业废水直接排放 B.工业废气处理后排放
C.禁止使用含磷洗衣粉 D.大量使用化肥、农药
(Ⅳ)能确认水是由氧元素和氢元素组成的实验是AC.
A.氢气在氧气中燃烧生成水 B.水的蒸发 C.水的电解 D.水的净化
(3)长期饮用硬水可能会引起体内结石,鉴别硬水和软水最简单的鉴别方法是用肥皂水鉴别.
(4)水通电分解生成最理想的能源-氢气,电解一定量的水,当其中负极产生5mL气体时,正极产生的气体体积是2.5mL.


 于排水法收集氧气,可在G中装满水后,将氧气从b口(“a”或“b”)进入.
于排水法收集氧气,可在G中装满水后,将氧气从b口(“a”或“b”)进入.
 自行车作为常用的代步工具,既轻便灵活,又符合环保要求,如图是一款自行车的示意图.
自行车作为常用的代步工具,既轻便灵活,又符合环保要求,如图是一款自行车的示意图.