题目内容
8.有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | 可能存在CO32- | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
分析 根据所加入的物质的性质和与离子Na+、NH4+、Ba2+、Cl-、CO32-、SO42-中的相关离子的反应现象进行分析、判断.
解答 解:①能与足量NaOH溶液加热产生气体的物质应为铵盐,因此溶液中应含有铵根离子;故一定存在NH4+;
②在溶液可能存在的五种离子中,能与氯化钡溶液反应形成的沉淀只有碳酸钡和硫酸钡,因此沉淀有三种情况①可能是碳酸钡;②可能是硫酸钡;③可能是既有碳酸钡又有硫酸钡;其中硫酸钡不溶于酸也不能与酸反应;而碳酸钡与酸能反应而沉淀质量减少
根据(得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g)故沉淀为:既有碳酸钡又有硫酸钡;确定原溶液中存在CO32-,SO42-.
因为Ba2+与CO32-、SO42-.在溶液中不能共存;确定原溶液中一定不存在Ba2+;故原溶液中一定存在NH4+、CO32-、SO42-、Na+,一定不存在Ba2+,可能存在Cl-,
故选C.
点评 本考点考查的是物质的鉴别,要根据题目给出的信息,由现象得出正确的结论.鉴别题是初中阶段的一个重点,可以根据不同的性质来鉴别,因此掌握好常见物质和酸碱盐的性质,问题就会迎刃而解.本考点主要出现在选择题和填空题中.

练习册系列答案
相关题目
3.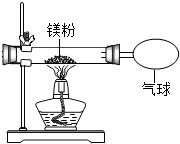 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
(1)请写出镁条与氧气反应的化学方程式2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO.
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律.我不同意(“同意”或“不同意”)小明的观点,因为所有的化学反应都遵循质量守恒定律.
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝.
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
空气中N2的含量计远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应.注意:若答对第(3)小题奖励4分,化学试卷总分不超过60分.
(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生H2,实验现象如表:
如表中,用水进行实验的目的是对比.根据上表中的实验现象,请写出三条结论,并分析可能的原因(不分析原因,不得分):①盐可以做镁与水反应的催化剂,因为盐能加快产生气体的速率;②温度改变反应速率,因为升高温度可以加快产生气体的速率;③升高温度能使反应更复杂,因为升高温度使镁与水反应的生成物在与盐反应生成氨气(NH3).
 某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.(1)请写出镁条与氧气反应的化学方程式2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO.
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵循质量守恒定律.我不同意(“同意”或“不同意”)小明的观点,因为所有的化学反应都遵循质量守恒定律.
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
【提出问题】黄色固体是什么呢?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝.
【做出猜想】黄色固体是Mg3N2
【实验探究】请设计实验,验证猜想
| 实验操作 | 实验现象及结论 |
| 将镁条燃烧的产物放在一只试管中,加入少量的蒸馏水,然后将一湿润的红色石蕊试纸放在试管口,观察现象 | 看到红色的石蕊试纸变成蓝色,说明黄色固体为氮化镁 |
(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生H2,实验现象如表:
| 实验序号 | 实验1 | 实验2 | 实验3 | |
| 与镁条反应的溶液 | NH4Cl | NaCl | Na2SO4 | H2O |
| 实验现象 | 有大量气泡产生 | 有较多气泡产生 | 有少量气泡产生 | 气泡极少 |
| 加热后,实验现象 | 气泡明显增多可闻到氨味 | 气泡增多 | 气泡增多 | 气泡增多 |
16.某化学兴趣小组对Ca(OH)2溶液和Na2CO3溶液反应后溶液中溶质的成分进行探究.请你一同探究并回答下列问题:
Ca(OH)2溶液与Na2CO3溶液反应的化学方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
【提出问题】:Ca(OH)2溶液和Na2CO3溶液反应后滤液中的溶质是什么?
【猜想假设】:甲同学认为:只含有NaOH
乙同学认为:只含有NaOH和Ca(OH)2;
丙同学认为:含有NaOH和Ca(OH)2和Na2CO3;
你认为可能含有NaOH、Na2CO3.
【分析讨论】:丁同学认为丙同学的猜想肯定是不合理的,理由是氢氧化钙和碳酸钠不会同时剩余.
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的.
【反思拓展】:在分析化学反应后所得物质的成分时,除了考虑生成物外,还需要考虑反应物是否剩余.
Ca(OH)2溶液与Na2CO3溶液反应的化学方程式Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
【提出问题】:Ca(OH)2溶液和Na2CO3溶液反应后滤液中的溶质是什么?
【猜想假设】:甲同学认为:只含有NaOH
乙同学认为:只含有NaOH和Ca(OH)2;
丙同学认为:含有NaOH和Ca(OH)2和Na2CO3;
你认为可能含有NaOH、Na2CO3.
【分析讨论】:丁同学认为丙同学的猜想肯定是不合理的,理由是氢氧化钙和碳酸钠不会同时剩余.
【实验设计】:请你设计一个简单的实验来验证你的猜想是正确的.
| 实验步骤 | 实验现象 | 实验结论 |
| 取反应后的溶液于试管中, 加入氯化钙溶液. | 产生白色沉淀. | 反应化学方程式:CaCl2+Na2CO3═CaCO3↓+2NaCl 你的猜想正确. |
3.产生下列现象,只与空气中的水蒸气有关的是( )
| A. | 固体烧碱要密封存放 | |
| B. | 浓硫酸露置于空气中会增重、变稀 | |
| C. | 浓盐酸露置于空气中会变轻、变稀 | |
| D. | 铜制品长期放在空气中会产生“铜锈”[又称“铜绿”,化学式为Cu2(OH)2CO3] |
20.某化学学习小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动.
(1)该反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①②③
①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③氢氧化钠.
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况②(填序号)是不可能的.
为了进一步确定溶液的成分,同学们设计了如下实验方案:
小红选择了另外一种不同类别的物质CO2(填化学式),也得到了同样的结论.
在同学们的合作下,他们顺利完成了探究任务.
(1)该反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①②③
①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③氢氧化钠.
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况②(填序号)是不可能的.
为了进一步确定溶液的成分,同学们设计了如下实验方案:
| 实验步骤 | 现象 | 结论 |
| 情况①正确 |
在同学们的合作下,他们顺利完成了探究任务.
18.三聚氰胺被人们称为“蛋奶精”,长期大量摄入对肾脏与膀胱可能产生影响,导致结石.三聚氰胺的化学式为C3H6N6,下列说法正确的是( )
| A. | 三聚氰胺是由3个碳原子、6个氢原子、6个氮原子构成 | |
| B. | 三聚氰胺中碳、氢、氮元素的质量比为6:1:14 | |
| C. | 三聚氰胺的相对分子质量为126g | |
| D. | 三聚氰胺可以做食品添加剂 |

 某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如图所示装置测定锌铜合金中锌、铜的质量分数. 如图是某一种微粒的结构示意图,试回答:
如图是某一种微粒的结构示意图,试回答: