题目内容
20.某化学学习小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动.(1)该反应的化学方程式为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①②③
①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③氢氧化钠.
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况②(填序号)是不可能的.
为了进一步确定溶液的成分,同学们设计了如下实验方案:
| 实验步骤 | 现象 | 结论 |
| 情况①正确 |
在同学们的合作下,他们顺利完成了探究任务.
分析 运用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH这个反应解答此题相关问题,反应后溶液中肯定含有氢氧化钠,若正好完全反应则只含氢氧化钠,若氢氧化钙有剩余则含有氢氧化钙和氢氧化钠,若碳酸钠有剩余则含氢氧化钠和碳酸钠.小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明不含碳酸钠故②不对.根据图表中的结论情况①正确,只要证明含有氢氧化钙即可,验证氢氧化钙选用碳酸钠或二氧化碳.
解答 解(1)氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(2)如果二者是恰好完全反应,则反应后的溶质只有氢氧化钠,故填:氢氧化钠;
(3)小新取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明不含碳酸钠,故填:②;
根据图表中的结论情况①正确,只要证明含有氢氧化钙即可,验证氢氧化钙选用碳酸钠,故填:
| 实验步骤 | 现象 | 结论 |
| 取少量溶液于试管中,加入少量Na2CO3溶液 | 产生白色沉淀 | 情况①正确 |
点评 典型的实验探究中的实验分析题,只有熟练掌握所学知识才能明白实验的设计,才能顺利得出正确答案.

练习册系列答案
相关题目
11.图为A、B、C为三种物质的溶解度曲线,下列说法正确的是( )


| A. | t2℃时,将A和C的混合溶液(两者均已达到饱和),降温至t1℃,析出的晶体含有A和C | |
| B. | t2℃时,将A、B、C的饱和溶液分别降温至t1℃,所得溶液中溶质质量分数的大小关系是B>A>C | |
| C. | 在P点A和C的溶解度曲线相交,说明t1℃时A和C 的溶解度相等 | |
| D. | t1℃时,欲用A的饱和溶液配制10%的A溶液,只需要烧杯、量筒、胶头滴管三种玻璃仪器 |
8.有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:
①第一份加足量NaOH溶液,加热,收集到气体0.68g;
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
①第一份加足量NaOH溶液,加热,收集到气体0.68g;
②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | 可能存在CO32- | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
5.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试
纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思 老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是pH试纸浸入溶液中.
(2)实验方案中也有一个是错误的,错误的原因是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是猜想四.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试
纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |  |  | 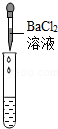 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡 产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【评价反思 老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是pH试纸浸入溶液中.
(2)实验方案中也有一个是错误的,错误的原因是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
12.以下对O2、CO2、SO2、MnO2四种物质的组成的说法中,正确的是( )
| A. | 都含有2个氧原子 | B. | 都含有氧分子 | C. | 都含有2个氧元素 | D. | 都含有氧元素 |
 我国食品安全法规定有些食品不允许添加防腐剂,因此有些食品包装中有一个单独包装的保鲜剂.某化学兴趣小组成员将家中一包(如图1)放置一段时间的食品保鲜剂带到学校,并邀兴趣小组的同学在化学实验室进行探究:
我国食品安全法规定有些食品不允许添加防腐剂,因此有些食品包装中有一个单独包装的保鲜剂.某化学兴趣小组成员将家中一包(如图1)放置一段时间的食品保鲜剂带到学校,并邀兴趣小组的同学在化学实验室进行探究: