题目内容
实验室有一瓶未知浓度的氯化钡溶液,为测定其浓度做了如下实验:取该溶液20.0mL(密度约为1.0g/mL)放入锥形瓶中,逐滴加入一定量9.8%的硫酸溶液至恰好完全反应.过滤、洗涤、干燥,称量沉淀质量为2.33g.请计算:(所有计算结果保留小数点后一位)
(1)20.0mL氯化钡溶液中氯化钡的质量是多少?其溶质质量分数是多少?
(2)欲配制100.0g 9.8%的稀硫酸完成该实验,需要98.0%的浓硫酸多少克?
(1)20.0mL氯化钡溶液中氯化钡的质量是多少?其溶质质量分数是多少?
(2)欲配制100.0g 9.8%的稀硫酸完成该实验,需要98.0%的浓硫酸多少克?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据生成沉淀质量结合化学方程式可以计算出氯化钡的质量,进而求出其溶质质量分数;
(2)根据稀释溶液时溶质质量不变解答;
(2)根据稀释溶液时溶质质量不变解答;
解答:解:(1)设,溶液中氯化钡的质量为x,
BaCl2+H2SO4=BaSO4↓+2HCl
208 233
x 23.3g
=
x=2.08g
氯化钡溶液中溶质质量分数是:
×100%=10.4%;
答:20.0mL氯化钡溶液中氯化钡的质量是2.08g,氯化钡溶液中溶质质量分数是10.4%.
(2)设,需要98.0%的浓硫酸的质量为y,
100.0g×9.8%=y×98.0%
y=10g
答:需要98.0%的浓硫酸10g.
BaCl2+H2SO4=BaSO4↓+2HCl
208 233
x 23.3g
| 208 |
| x |
| 233 |
| 2.33g |
x=2.08g
氯化钡溶液中溶质质量分数是:
| 2.08g |
| 20.0ml×1.0g/ml |
答:20.0mL氯化钡溶液中氯化钡的质量是2.08g,氯化钡溶液中溶质质量分数是10.4%.
(2)设,需要98.0%的浓硫酸的质量为y,
100.0g×9.8%=y×98.0%
y=10g
答:需要98.0%的浓硫酸10g.
点评:根据化学方程式进行计算的步骤一般为设出未知数,写出配平的化学方程式,求出相关物质的质量比,列出比例式,求解,答,共六步.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目
已知分子的质量越小,分子运动速度越快,且氯化氢分子的质量大于氨气分子的质量,如图在玻璃管两端的棉花上分别滴上浓氨水和浓盐酸,已知浓氨水易挥发出氨气,浓盐酸易挥发出氯化氢气体.氨气和氯化氢两种气体接触后会产生大量白烟,则白烟较多较浓的点是( )


| A、A点 | B、B点 |
| C、C点 | D、无法确定 |
下列物质的用途不正确的是( )
A、 液氮作冷冻麻醉 |
B、 氮气作闪光灯 |
C、 二氧化碳作肥料 |
D、 氧气用于炼钢 |
 碳元素是组成许多物质的基本元素.
碳元素是组成许多物质的基本元素.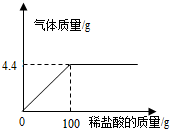 化学探究小组为测定石灰石样品中碳酸钙的质量分数,取15g样品放入烧杯,然后逐滴加入一定质量分数的盐酸反应(杂质不溶于水也不参与反应),加入的酸与生成气体的关系如下.请完成:
化学探究小组为测定石灰石样品中碳酸钙的质量分数,取15g样品放入烧杯,然后逐滴加入一定质量分数的盐酸反应(杂质不溶于水也不参与反应),加入的酸与生成气体的关系如下.请完成: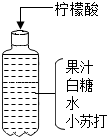 小华按如图配方自制了一瓶清凉甘甜的汽水.根据图中信息回答:
小华按如图配方自制了一瓶清凉甘甜的汽水.根据图中信息回答: